
(1)___Fe(CrO2)+___ Na2CO3+__O2==___Na2CrO4+___ Fe2O3+___CO2
(2)____Fe3O4+____K2Cr2O7+___H2SO4=___K2SO4+____ Cr2(SO4)3+___Fe2(SO4)3+__口
(3) 配平下列反应方程式:
____NH4NO3 = ____HNO3+____N2+____H2O
发生氧化反应的氮原子和发生还原反应的氮原子个数比为____.( )
科目:高中化学 来源: 题型:阅读理解
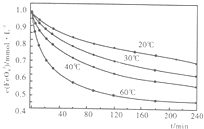 (2010?安徽模拟)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝、杀菌、灭菌、去浊、脱色、除臭为一体的新型、高效、绿色环保的多功能水处理剂.近十几年来,我国对高铁酸钾在饮用水处理中的应用的研究也不断深入,已取得可喜成果.比较理想的制备方法是次氯酸盐氧化法:先向KOH溶液中通入足量Cl2制备次氯酸钾饱和溶液,再分次加入KOH固体,得到次氯酸钾强碱性饱和溶液,加入三价铁盐,合成高铁酸钾.
(2010?安徽模拟)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝、杀菌、灭菌、去浊、脱色、除臭为一体的新型、高效、绿色环保的多功能水处理剂.近十几年来,我国对高铁酸钾在饮用水处理中的应用的研究也不断深入,已取得可喜成果.比较理想的制备方法是次氯酸盐氧化法:先向KOH溶液中通入足量Cl2制备次氯酸钾饱和溶液,再分次加入KOH固体,得到次氯酸钾强碱性饱和溶液,加入三价铁盐,合成高铁酸钾.| 放电 |
| 充电 |
| cV1 |
| 3V |
| cV1 |
| 3V |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 7 |
2- 4 |
2- 4 |
| H+ |
| ①转化 |
2- 7 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
2- 4 |
2- 7 |
2- 7 |
2- 4 |
2- 7 |
2- 4 |
2- 7 |
2- 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
2- 7 |
2- 7 |
2- 4 |
2- 7 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废水中常含有一定量的Cr2O![]() 和CrO
和CrO![]() ,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
CrO![]()
![]() Cr2O
Cr2O![]()
![]() Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:
2CrO![]() (黄色)+2H+
(黄色)+2H+![]() Cr2O
Cr2O![]() (橙色)+H2O
(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是__________。
a.Cr2O![]() 和CrO
和CrO![]() 的浓度相同
的浓度相同
b.2v(Cr2O![]() )=v(CrO
)=v(CrO![]() )
)
c.溶液的颜色不变
(3)第②步中,还原1 mol Cr2O![]() 离子,需要________mol的FeSO4·7H2O。
离子,需要________mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至________。
方法2:电解法
该法用Fe做电极电解含Cr2O![]() 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为________________________________________
________________________________________________________。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)________________________。溶液中同时生成的沉淀还有__________。
查看答案和解析>>
科目:高中化学 来源:2012届度江西省上学期高三期末考试化学试卷 题型:填空题
(12分)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
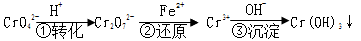
其中第①步存在平衡: 2CrO42-(黄色)+2H+  Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)能说明第①步反应达平衡状态的是 。
a.Cr O
O 和CrO
和CrO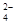 的浓度相同
的浓度相同
b.2v (Cr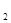 O
O )
=v (CrO
)
=v (CrO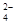 )
)
c.溶液的颜色不变
(3)第②步中,还原1mol Cr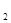 O
O 离子,需要 mol的FeSO
离子,需要 mol的FeSO ·7H
·7H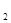 O。
O。
(4)第③步生成的Cr(OH) 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡:
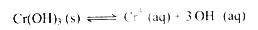
常温下,Cr(OH) 的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32要使c(Cr3+)降至10
的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32要使c(Cr3+)降至10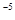 mol/L,溶液的pH应调至
。
mol/L,溶液的pH应调至
。
方法2:电解法
该法用Fe做电极电解含Cr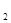 O
O 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH) 沉淀。
沉淀。
(5)用Fe做电极的原因为 。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释) 。
溶液中同时生成的沉淀还有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com