
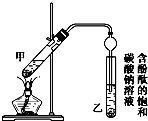
 硝基苯是一种重要的化工原料,其制备原理是:
硝基苯是一种重要的化工原料,其制备原理是: +HO-NO2$→_{50~60℃}^{H_{2}SO_{4}}$
+HO-NO2$→_{50~60℃}^{H_{2}SO_{4}}$ +H2O△H<0
+H2O△H<0 +HO-NO2$→_{△}^{H_{2}SO_{4}}$
+HO-NO2$→_{△}^{H_{2}SO_{4}}$ +H2O
+H2O分析 (1)根据浓硫酸溶于水放出大量的热,且浓硫酸的密度大于硝酸,从实验安全的角度答题;
(2)备硝基苯的反应为放热反应,反应物硝酸、苯都是易挥发的物质,为了提高反应物的转化率,对反应物要冷凝回流;
(3)①备硝基苯的反应为放热反应,反应过快反应温度升高快,会发生副反应生成副产物间二硝基苯,所以要通过控制滴加反应物的量来控制反应速率;
②反应要控制在50~60℃,可以通过水浴加热的方法;
③硝基苯的密度大于水,据此判断粗产品的位置,苯和硝基苯及间二硝基苯互溶但它们的沸点不同,据此可以确定除去硝基苯中没有反应的苯和生成的副产物的简便方法.
解答 解:(1)根据浓硫酸溶于水放出大量的热,且浓硫酸的密度大于硝酸,从实验安全的角度可知,混酸的配制操作过程为在100 mL 的烧杯中先加入18 mL 浓硝酸,然后缓慢加入20 mL 浓硫酸,不断搅拌,冷却到50~60℃,
故答案为:在100 mL 的烧杯中先加入18 mL 浓硝酸,然后缓慢加入20 mL 浓硫酸,不断搅拌,冷却到50~60℃;
(2)备硝基苯的反应为放热反应,反应物硝酸、苯都是易挥发的物质,为了提高反应物的转化率,对反应物要冷凝回流,所以实验中冷凝管的作用是冷凝回流,防止苯和硝酸挥发,
故答案为:冷凝回流,防止苯和硝酸挥发;
(3)①备硝基苯的反应为放热反应,反应过快反应温度升高快,会发生副反应生成副产物间二硝基苯,所以要通过控制滴加反应物的量来控制反应速率,故逐滴滴加混酸,边滴加边搅拌,这样做的目的是防止反应进行得过快,使温度升高得过快,增加反应的副产物,
故答案为:防止反应进行得过快,使温度升高得过快,增加反应的副产物;
②反应要控制在50~60℃,可以通过水浴加热的方法,
故答案为:水浴加热;
③硝基苯的密度大于水,所以粗产品在下层,苯和硝基苯及间二硝基苯互溶但它们的沸点不同,所以除去硝基苯中没有反应的苯和生成的副产物的简便方法是蒸馏,
故答案为:下;蒸馏.
点评 本题主要考查硝基苯的制备、提纯,难度中等,答题时注意有机物性质与实验基本操作的灵活应用.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A. | 反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.10mol SO3和0.010mol O2,到达平衡时,n(SO2)=0.012mol | |
| C. | 保持其他条件不变,升高温度,平衡时c(SO2)=0.0070mol•L-1,则反应的△H>0 | |
| D. | 相同温度下,起始时向容器中充入0.050mol SO2和0.030mol O2,达到平衡时SO2转化率大于88% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 实验 | 乙醇(mL) | 乙酸(mL) | 乙酸乙酯(mL) |
| ① | 2 | 2 | 1.33 |
| ② | 3 | 2 | 1.57 |
| ③ | 4 | 2 | x |
| ④ | 5 | 2 | 1.76 |
| ⑤ | 2 | 3 | 1.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 B(OH)4-+H+;
B(OH)4-+H+;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用甲烷和二氧化碳可以制备化工原料.
用甲烷和二氧化碳可以制备化工原料.| 物质 | H2 | CO | CH4 | CH3COOH |
| 燃烧热(kJ/mol) | 286 | 283 | 890 | 874 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质. |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一. |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物. |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、H+、Cl-、OH- | B. | Na+、Ba2+、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$ | ||
| C. | Na+、H+、Cu2+、SO${\;}_{4}^{2-}$ | D. | K+、Zn2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com