
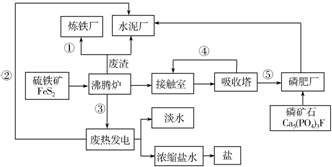
分析 (1)根据流程图中工业生产的原料,及发生的反应中的能量转化分析;
(2)沸腾炉中FeS2与氧气反应;根据反应物、生成物及质量守恒定律形成该反应的方程式;
(3)根据FeS2制取硫酸过程中涉及的化学反应方程式,利用关系法解题;
(4)①石灰乳能将镁离子转化为沉淀;
②镁离子水解,应抑制其水解得到无水盐;
③用作镁蒸气的冷却剂,应不与Mg反应,以此来解答.;
(5)石灰石中的碳酸钙在高温条件下分解能生成氧化钙和二氧化碳,氧化钙能和二氧化硅反应生成硅酸钙,从而除去铁矿石中的二氧化硅.
解答 解:(1)①中冶炼钢铁的原料是Fe2O3,②中热电厂中向外提供的能量为电能,③沸腾炉中FeS2与氧气反应放出大量的热,④制硫酸时接触室中二氧化硫被氧化,⑤硫酸工业中生成的硫酸,可用于制磷肥,
故答案为:①Fe2O3 ③热能 ④SO2 ;
(2)沸腾炉中FeS2与氧气反应生成Fe2O3和SO2,其反应方程式为:4FeS2+1102$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;
普钙是磷酸二氢钙和硫酸钙,磷矿石和硫酸反应制普钙的化学方程式为:2Ca5(PO4)3F+7H2SO4=3Ca(H2PO4)2+7CaSO4+2HF,
故答案为:4FeS2+1102$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;2Ca5(PO4)3F+7H2SO4=3Ca(H2PO4)2+7CaSO4+2HF;
(3)FeS2制取硫酸过程中,设生成的98%的硫酸为x吨,利用关系法列式,硫元素守恒,
FeS2 ~2H2SO4
120 2×98
1×72%×65% 98%x
则:$\frac{120}{1×72%×65%}$=$\frac{2×98}{98%x}$,解得:x=0.78,
故答案为:0.78;
(4)①石灰乳能将镁离子转化为沉淀,则在母液中加入石灰乳所起的作用是沉淀Mg2+,
故答案为:沉淀Mg2+;
②镁离子水解,应抑制其水解得到无水盐,所以利用MgCl2•6H2O制得无水氯化镁,应采取的措施是在干燥HCl气流中脱水,抑制MgCl2水解,
故答案为:在干燥HCl气流中脱水,抑制MgCl2水解;
③用作镁蒸气的冷却剂,应不与Mg反应,只有A符合,而Mg与二氧化碳、氧气、水蒸气等均可反应,
故答案为:A;
(5)石灰石中的碳酸钙在高温条件下分解能生成氧化钙和二氧化碳,氧化钙能和二氧化硅反应生成硅酸钙,从而除去铁矿石中的二氧化硅,
故答案为:碳酸钙.
点评 本题考查了物质分离、提纯方法及其综合应用用,题目难度中等,涉及制备方案的设计、物质的分离与提纯方法、盐的水解原理、化学计算等知识,根据流程明确实验原理为解答关键,试题培养了学生的分析能力及化学实验能力.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | 第二层的电子数是第一层电子数的3倍 |
| Y | 元素的原子中没有中子 |
| Z | 第二层电子数是第一层和第三层电子数之和 |
| X、W、M | X2-、W2+、M3+具有相同的电子层结构 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
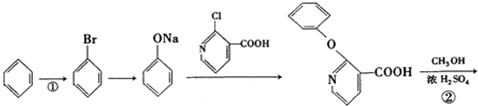

 +H2N-NH2→
+H2N-NH2→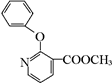 +CH3OH,
+CH3OH, ,
,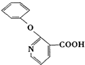 的分子式为C12H9O3N,它有多种同分异构体,其中符合下列条件的同分异构体共有4种.
的分子式为C12H9O3N,它有多种同分异构体,其中符合下列条件的同分异构体共有4种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
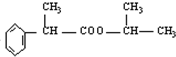
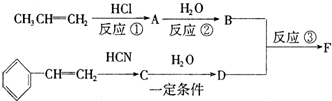
 .
.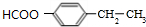 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
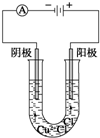 按如图所示装置进行探究实验:电解CuCl2溶液
按如图所示装置进行探究实验:电解CuCl2溶液查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH的浓度比NaOH溶液大,反应后醋酸过量呈酸性 | |
| B. | CH3COOH溶液中水的电离程度大于NaOH溶液中水的电离程度 | |
| C. | 反应后溶液中的离子浓度一定是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 反应后的溶液中c(Na+)与c(CH3COO-)可能相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 装置 |  |  |  |  |
| 目的 | 收集NH3并验证其水溶液的碱性 | 制备氯气 | 配制-定浓度的NaOH溶液 | 加热明矾制备无水硫酸铜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{m+A}$(A-N+m)mol | B. | $\frac{a}{A}$(A一N)mol | C. | $\frac{a}{m+A}$(A-N)mol | D. | $\frac{a}{A}$(A一N+m)mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com