
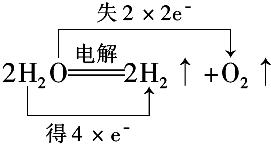
 .
. 分析 (1)水只作氧化剂,说明水中元素得电子化合价降低;水只作还原剂说明水中元素失电子化合价升高;水既是氧化剂又是还原剂,说明水中元素化合价升高和降低;水既不是氧化剂又不是还原剂,说明水中各元素化合价不变;
(2)D中H元素化合价由+1价变为0价、O元素化合价由-2价变为0价,转移电子数为4.
解答 解:(1)A.F元素化合价由0价变为-1价、O元素化合价由-2价变为0价,所以水作还原剂;
B.Na元素化合价由0价变为+2价、H元素化合价由+1价变为0价,所以水是氧化剂;
C.该反应中各元素化合价不变,所以不是氧化还原反应;
D.该反应中H元素化合价由+1价变为0价、O元素化合价由-2价变为0价,所以氧化剂和还原剂,
通过以上分析知,水只作氧化剂的是B、水只作还原剂的是A,水既作氧化剂又作还原剂的是D,水既不作氧化剂又不作还原剂的是C,故答案为:B;A;D;C;
(2)D中H元素化合价由+1价变为0价、O元素化合价由-2价变为0价,转移电子数为4,电子转移方向和数目为 ,
,
故答案为: .
.
点评 本题考查氧化还原反应,侧重考查基本概念及电子转移方向和数目判断,根据元素化合价变化确定物质性质,难点是电子转移方向和数目判断.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源:2016-2017学年吉林省长春市高一上学期期初考试化学试卷 题型:选择题
已知NaCl、Na2SO4、Na3PO4三种溶质的物质的量浓度之比是1:1:2,三种溶液的体积比为2:2:1,则这三种溶液中Na+个数比是
A.1:3:6
B.2:3:9
C.9:3:1
D.1:2:3
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
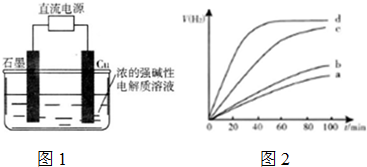
| 时间/min | 20 | 40 | 60 | 80 |
| N(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂在过量氧气中燃烧,主要产物是Li2O而不是Li2O2 | |
| B. | Li2CO3受热很难分解 | |
| C. | 在相同温度下,溶解度Li2CO3小于LiHCO3 | |
| D. | 少量的锂保存在固体石蜡中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
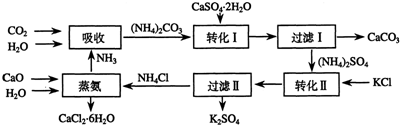
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2>MnO2>KMnO4 | B. | KMnO4>MnO2>O2 | C. | MnO2>KMnO4>O2 | D. | O2>KMnO4>MnO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com