
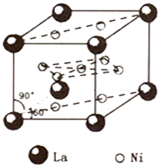
 镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.
镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.分析 (1)Ni的原子数序为28,位于周期表第四周期第Ⅷ族;
(2)CO的电子数为14,含有2个原子,根据等电子体的定义分析;根据NH3中N原子的δ键判断杂化类型;根据CO的相邻和相对位置判断同分异构体数目;
(3)结合能量最低原理书写离子的电子排布式;NiO(OH)具有氧化性,与盐酸发生氧化还原反应;
(4)利用均摊法计算晶胞的结构.
解答 解:(1)Ni的原子数序为28,位于周期表第四周期第Ⅷ族,
故答案为:第四周期,第Ⅷ族;
(2)CO的电子数为14,含有2个原子,它的等电子体有等CN-、C22-;NH3中N原子形成3个δ键,孤电子对数目孤$\frac{1}{2}$(5-3×1)=1,价层电子对数目为3+1=4,为杂化sp3;氨气易液化,液化时吸收大量的热,可用作制冷剂;[Ni(CO)2(NH3)4]2+的结构中,CO可位于平面的相邻和相对两种位置,
故答案为:CN-、C22-;sp3;液态氨汽化时需吸收大量的热;2;
(3)Ni3+的电子排布式为:[Ar]3d7或1s22s22p63s23p63d7,NiO(OH)具有氧化性,与盐酸发生氧化还原反应,化学方程式为2NiO(OH)+6HCl(浓)=2NiCl2+Cl2↑+4H2O,
故答案为:[Ar]3d7或1s22s22p63s23p63d7;2NiO(OH)+6HCl(浓)=2NiCl2+Cl2↑+4H2O;
(4)由晶胞结构可知,晶胞中La位于顶点,共有8×$\frac{1}{8}$=1,Ni位于面心和体心,面心共有8×$\frac{1}{2}$=4,体心为1,共有5个Ni原子,故该物质中La原子、Ni原子数目之比=1:5,则x=5,
故答案为:5.
点评 本题考查较为综合,涉及物质结构与性质的考查,题目难度中等,本题注意等电子体的判断,利用均摊法计算晶胞的结构,学习中注意杂化类型的判断、电子排布式的书写等方法性的问题.


科目:高中化学 来源: 题型:解答题
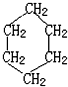 ,名称是环己烷
,名称是环己烷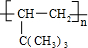 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径:Br<Cl<F | B. | 热稳定性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO4<H2CO3<H3PO4 | D. | 沸点:乙酸>乙醇>乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅由非金属元素不可能形成离子化合物 | |
| B. | 构成分子的粒子一定含有共价键 | |
| C. | 离子化合物中可能含有共价键 | |
| D. | 凡是有化学键断裂过程一定发生了化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用含0.1molFeCl3的溶液与足量沸水反应制得的Fe(OH)3胶体粒数为0.1NA | |
| B. | 46gNO2和N2O4的混合气体中含N原子总数为NA | |
| C. | 标准状况下,5.6LCCl4含有的分子数为0.25NA | |
| D. | 0.25molNa2O2中含有的阴离子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4 | B. | (NH4)2SO4 | C. | NH3•H2O | D. | NH4HSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电反应的化学方程式为:2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr,下列关于此电池说法正确的是( )
如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电反应的化学方程式为:2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr,下列关于此电池说法正确的是( )| A. | 充电过程中,当0.1 mol Na+通过离子交换膜时,导线通过0.1 mol电子 | |
| B. | 电池放电时,负极反应为:3NaBr一2e-═NaBr3+2Na+ | |
| C. | 充电过程中钠离子从右到左通过离子交换膜 | |
| D. | 放电过程中钠离子从左到右通过离子交换膜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com