
| A. | ①③⑤⑥ | B. | ②④⑤⑥ | C. | ③⑤ | D. | ③⑥ |
分析 ①电解质的强弱与溶解性无关;
②部分盐属于弱电解质;
③弱电解质包括弱酸、弱碱和少部分盐以及水;
④H+浓度与酸的浓度、分子中氢离子的个数以及电离程度有关,与电解质的强弱无关;
⑤溶液导电的原因是溶液中有自由移动的阴阳离子;
⑥酸在熔融态时不导电.
解答 解:①电解质的强弱与溶解性无关,不溶于水的盐可能是强电解质,CaCO3、BaSO4均是强电解质,故①错误;
②绝大多数的盐属于强电解质,少部分盐属于弱电解质,如醋酸铅就属于弱电解质,故②错误;
③弱电解质包括弱酸、弱碱和少部分盐以及水,故③正确;
④强酸溶液中的H+浓度不一定大于弱酸溶液中的H+浓度,H+浓度与酸的浓度、分子中氢离子的个数以及电离程度有关,与电解质的强弱无关,故④错误;
⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子,故⑤正确;
⑥酸为共价化合物,在熔融态时均不导电,只有溶于水时才导电,故⑥错误;
故选C.
点评 本题主要考查的是强弱电解质的概念以及判断,涉及溶液导电的原因、溶液中离子浓度大小比较等,难度不大.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| C | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| D | 向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪去 | 使溶液褪色的气体是乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数 | B. | 电子数 | C. | 中子数 | D. | 质量数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将集有气体样品的试管倒扣于水槽中,试管中液面上升,则原气体样品中一定含NH3 | |
| B. | 将带火星的木条伸入盛满气体样品的集气瓶中,木条未复燃,则原气体样品中一定不含O2 | |
| C. | 将一定体积气体样品缓缓通入澄清石灰水中,未见有白色沉淀,则原气体样品中一定不含CO2 | |
| D. | 将一定体积气体样品缓缓通入水中,恰好完全反应生成一种盐,向所得盐溶液中加入澄清石灰水,未见沉淀生成,则原气体样品中V(NH3):V(O2)=4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
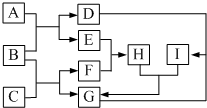 有关物质的转化关系如图所示(部分物质和条件已略去).F是最简单的烃,B是最常见的无色液体,A是一种淡黄色固体,G是一种既能溶于强酸又能溶于强碱的白色固体,C由两种短周期元素组成,其摩尔质量为144g•mol-1.
有关物质的转化关系如图所示(部分物质和条件已略去).F是最简单的烃,B是最常见的无色液体,A是一种淡黄色固体,G是一种既能溶于强酸又能溶于强碱的白色固体,C由两种短周期元素组成,其摩尔质量为144g•mol-1. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在反应KC1O3+6HCl(浓)═KC1+3C12↑+3H2O中,每生成3 mol Cl2转移的电子数为NA | |
| B. | 1 mol K2S固体中含有3 NA个离子 | |
| C. | 1 mol 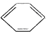 分子中含碳碳双键数为3 NA 分子中含碳碳双键数为3 NA | |
| D. | 含有NA个氖原子的氖气在标准状况下的体积约为11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
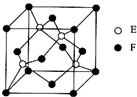 A,B,C,D,E,F是原子序数依次增大的六种前四周期元素,其相关信息如表所示:
A,B,C,D,E,F是原子序数依次增大的六种前四周期元素,其相关信息如表所示:| A | 原子半径最小的元素 |
| B | 原子核外电子有6种不同的运动状态 |
| D | 原子L电子层上有2对成对电子 |
| E | E与D同主族 |
| F | 基态F+核外有3层电子且各层均处于全满状态 |
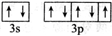 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
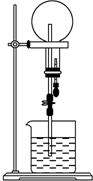 已知NH3和HCl都是能用来做喷泉实验的气体.若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl和N2的混合气体,如图所示.喷泉实验停止后,两个烧瓶内溶液的关系是(不考虑烧瓶内溶质的扩散,氨水的溶质按NH3计算)( )
已知NH3和HCl都是能用来做喷泉实验的气体.若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl和N2的混合气体,如图所示.喷泉实验停止后,两个烧瓶内溶液的关系是(不考虑烧瓶内溶质的扩散,氨水的溶质按NH3计算)( )| A. | 溶质的物质的量浓度相同、溶质的质量分数不同 | |
| B. | 溶质的质量分数相同、溶质的物质的量浓度不同 | |
| C. | 溶质的物质的量浓度和溶质的质量分数都不同 | |
| D. | 溶质的物质的量浓度和溶质的质量分数都相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是否是大量分子或离子的集合体 | B. | 分散质微粒直径的大小不同 | ||
| C. | 是否有丁达尔效应 | D. | 是否均一、稳定、透明 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com