
偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2(l)+2N2O4(l)====2CO2(g)+3N2(g)+4H2O(g)(Ⅰ)
(1)反应(Ⅰ)中氧化剂是________。
(2)火箭残骸中常见红棕色气体,原因为:
N2O4(g)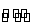 2NO2(g)(Ⅱ)
2NO2(g)(Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为______(填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。
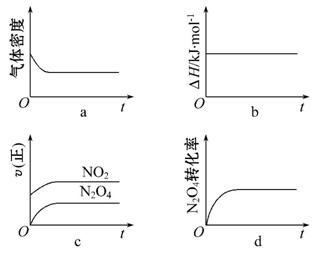
若在相同温度下,上述反应改在体积为1 L的恒容密闭容器中进行,平衡常数______________(填“增大”“不变”或“减小”),反应3 s后NO2的物质的量为0.6 mol,则0~3 s内的平均反应速率v(N2O4)=____________mol·L-1·s-1。
(4)NO2可用氨水吸收生成NH4NO3。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是________(用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将____(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为________mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5mol·L-1)
【解析】(1)分析元素的化合价可知,氮元素的化合价由N2O4中的+4价,变成了生成物N2中的0价,故可知N2O4为氧化剂。
(2)由温度升高时,红棕色加深,说明升温平衡向生成NO2的方向移动,即该反应的正反应为吸热反应。
(3)作为化学平衡状态的标志,须由原来的“变量”变到“不变量”,方可说明,在恒压条件下,随着反应的进行生成NO2,气体的总的物质的量不断增加,容器的体积增大,故密度变小,当密度不变时,可说明化学反应达到平衡状态,a正确;b图,作为反应热,ΔH只与这个化学方程式有关,是一个不变量,它不会随着反应“量”的变化而变化,b错误;c图,用化学反应速率判断可逆反应是否达到平衡状态时,一定是“异向”,且它们的反应速率之比等于化学计量数之比,故c错误;d图,当N2O4的转化率不变时,说明v(正)=v(逆),反应达到了平衡状态,d正确。平衡常数是温度的函数,只受温度的影响,故温度不变,化学平衡常数不变。由题意可知,NO2的化学反应速率,v(NO2)=0.2 mol·L-1·s-1,由化学反应速率之比等于化学计量数之比,得出v(N2O4)=0.1 mol·L-1·s-1。
(4)NH4NO3溶液呈酸性,原因是N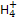 发生了水解反应,对应的水解方程式为:N
发生了水解反应,对应的水解方程式为:N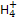 +H2O
+H2O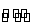 NH3·H2O+H+。滴加氨水后溶液由酸性变为中性,水的电离平衡向逆反应方向移动。由Kb=
NH3·H2O+H+。滴加氨水后溶液由酸性变为中性,水的电离平衡向逆反应方向移动。由Kb=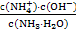 =2×10-5mol·L-1,c(OH-)=10-7mol·L-1,则c(N
=2×10-5mol·L-1,c(OH-)=10-7mol·L-1,则c(N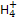 )=200c(NH3·H2O),故n(N
)=200c(NH3·H2O),故n(N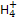 )=200n(NH3·H2O),根据电荷守恒可知n(N
)=200n(NH3·H2O),根据电荷守恒可知n(N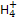 )=n(N
)=n(N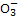 ),则溶液中n(N
),则溶液中n(N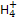 )+n(NH3·H2O)=a+
)+n(NH3·H2O)=a+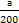 ,根据物料守恒,滴加氨水的物质的量浓度c=(a+
,根据物料守恒,滴加氨水的物质的量浓度c=(a+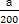 -a)mol÷bL=
-a)mol÷bL=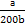 mol·L-1。
mol·L-1。
答案:(1)N2O4 (2)吸热 (3)a、d 不变 0.1
(4)N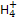 +H2O
+H2O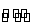 NH3·H2O+H+ 逆向
NH3·H2O+H+ 逆向 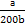


科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A.反应NH3(g)+HCl(g)=== NH4Cl(s)在室温下可自发进行,则该反应的△H>0
B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
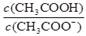 C.CH3COOH 溶液加水稀释后,溶液中 的值减小
C.CH3COOH 溶液加水稀释后,溶液中 的值减小
D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MHNi电池)。下列有关说法不正确的是( )
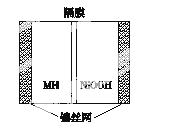
A.放电时正极反应为NiOOH+H2O+e-—→Ni(OH)2+OH-
B.电池的电解液可为KOH溶液
C.充电时负极反应为MH+OH-—→H2O+M+e-
D.MH是一类储氢材料,其氢密度越大,电池的能量密度越高
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上由黄铜矿(主要成分CuFe S2)冶炼铜的主要流程如下:
S2)冶炼铜的主要流程如下:
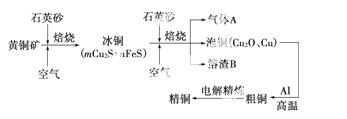
(1)气体A中的大气污染物可选用下列试剂中的________吸收。
A.浓H2SO4 B.稀HNO3
C.NaOH溶液 D.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在________(填离子符号),检验溶液中还存在Fe2+的方法是__________________________________________________
__________________________________________________(注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为__________________________________________________。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是________。
A.电能全部转化为化学能
B.粗铜接电源正极,发生氧化反应
C.溶液中Cu2+向阳极移动
D.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4== =2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为__________________________________________________。
=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述与图像对应符合的是( )
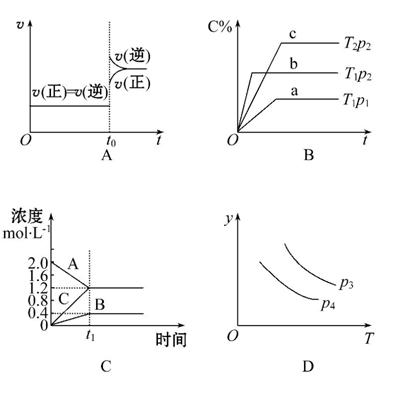
A.对于达到平衡状态的N2(g)+3H2(g)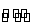 2NH3(g)在t0时刻充入了一定的NH3,平衡逆向移动
2NH3(g)在t0时刻充入了一定的NH3,平衡逆向移动
B.p2>p1,T1>T2
C.该图像表示的方程式为:2A====B+3C
D.对于反应2X(g)+3Y(g)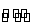 2Z(g) ΔH<0,y可以表示Y的百分含量
2Z(g) ΔH<0,y可以表示Y的百分含量
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式的书写正确的是
A.在硫酸铜溶液中加入过量氢氧化钡溶液 Ba2++SO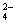 =BaSO4↓
=BaSO4↓
B.钠与水的反应Na + 2H2O === Na+ + 2OH -+ H2↑
C.氯气通入氢氧化钠溶液中 2Cl2+2OH- = 3Cl-+ClO-+H2O
D.大理石溶于醋酸的反应CaCO3 + 2CH3COOH === Ca2+ + 2CH3COO- +CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
关于胶体和溶液的叙述正确的是
A.胶体是一种不稳定的分散系,而溶液是一种非常稳定的分散系
B.胶体和溶液一定都是液体状态
C.胶体能够发生丁达尔效应,而溶液不能
D.胶体和溶液的分散质微粒直径都在1nm~100nm之间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com