
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
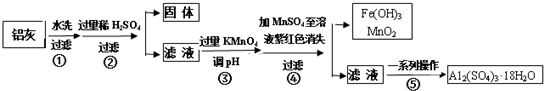
分析 铝灰水洗过滤除去不溶性杂质SiO2,加入过量稀硫酸酸溶过滤,得到滤液中含有Al3+、Fe3+、Fe2+,加入高锰酸钾溶液调节溶液PH氧化亚铁离子为铁离子,加入MnSO4和过量的高锰酸钾溶液反应生成二氧化锰沉淀,过滤得到滤液中主要是铝离子,经过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铝晶体,
(1)Al2O3溶于过量硫酸反应生成硫酸铝和水;
(2)过氧化氢酸性溶液中氧化硫酸亚铁为硫酸铁;
(3)步骤③是将亚铁离子氧化为铁离子,并将铁离子转化为氢氧化铁沉淀除去,调节pH值的范围是沉淀铁离子不沉淀铝离子2.8≤PH<3.4;
(4)当pH=2时,c(OH-)=1×10-12mol/L,根据Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-),可计算得Fe3+开始沉淀的浓度;
(5)操作④的作用是利用硫酸锰和高锰酸钾反应生成二氧化锰沉淀除去;为了验证该操作所得固体中确实含有MnO2,加入浓盐酸是否溶解生成 黄绿色气体检验;
(6)在操作⑤的“一系列操作”是蒸发浓缩,冷却结晶,过滤洗涤,依据操作风分析所需仪器;
解答 解:铝灰水洗过滤除去不溶性杂质SiO2,加入过量稀硫酸酸溶过滤,得到滤液中含有Al3+、Fe3+、Fe2+,加入高锰酸钾溶液调节溶液PH氧化亚铁离子为铁离子,加入MnSO4和过量的高锰酸钾溶液反应生成二氧化锰沉淀,过滤得到滤液中主要是铝离子,经过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铝晶体;
(1)Al2O3溶于过量硫酸反应生成硫酸铝和水,反应的离子方程式为:6H++Al2O3=2Al3++3H2O;
故答案为:6H++Al2O3=2Al3++3H2O;
(2)过氧化氢酸性溶液中氧化硫酸亚铁为硫酸铁,反应的化学方程式为:H2O2+2FeSO4+H2SO4=Fe2(SO4)3+2H2O;
故答案为:H2O2+2FeSO4+H2SO4=Fe2(SO4)3+2H2O;
(3)步骤③是将亚铁离子氧化为铁离子,并将铁离子转化为氢氧化铁沉淀除去,调节pH值的范围是沉淀铁离子不沉淀铝离子2.8≤PH<3.4;
故答案为:亚铁离子氧化为铁离子,并将铁离子转化为氢氧化铁沉淀除去;2.8≤PH<3.4;
(4)当pH=2时,c(OH-)=1×10-12mol/L,根据Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)可知,c(Fe3+)=$\frac{K{\;}_{sp}[Fe(OH){\;}_{3}]}{{c}^{3}(OH{\;}^{-})}$=$\frac{4.0×10{\;}^{-38}}{(1×10{\;}^{-12})^{3}}$=4.0×10-2mol/L,
故答案为:4.0×10-2mol/L;
(5)操作④的作用是利用硫酸锰和高锰酸钾反应生成二氧化锰沉淀除去;为了验证该操作所得固体中确实含有MnO2,反应的离子方程式为2MnO4-+3Mn2++2H2O=5MnO2+4H+,加入浓盐酸是否溶解生成 黄绿色气体检验或用双氧水,生成氧气检验;
故答案为:2MnO4-+3Mn2++2H2O=5MnO2+4H+;浓盐酸或双氧水;
(6)在操作⑤的“一系列操作”是蒸发浓缩,冷却结晶,过滤洗涤,依据操作分析所需仪器为蒸发皿,玻璃棒、酒精灯、漏斗,坩埚是给固体加热 的仪器,不需要坩埚;
故答案为:B.
点评 本题考查了金属化合物的性质,离子方程式书写,溶度积常数的应用及其实验仪器的选择,分析流程掌握物质选择和实验基本操作是解题关键,题目难度中等.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O).CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4•H2O+NaCl查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度相同,体积相同的O2和N2 | |
| B. | 质量相等,密度不等的N2和CO | |
| C. | 体积相等,密度相等的CO和C2H4 (C2H4 为乙烯气体) | |
| D. | 压强相同、体积相同的N2和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3+HCl═NH4Cl | B. | 4NH3+5O2$\frac{\underline{\;Pt\;}}{△}$4NO+6H2O | ||
| C. | 3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O | D. | 8NH3+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$6NH4Cl+N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
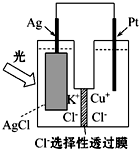 一种光化学电池的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )
一种光化学电池的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )| A. | 生成108 g银,转移电子个数为1 mol | |
| B. | Cu+在负极发生氧化反应 | |
| C. | Ag电极活泼,Ag失电子发生氧化反应 | |
| D. | Cl-由负极迁移到正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(PO43-):Na3PO4>Na2HPO4>NaH2PO4>H3PO4 | |
| B. | c(CO32-):(NH4)2CO3>Na2CO3>NaHCO3>NH4HCO3 | |
| C. | c(NH4+):(NH4)2SO4>(NH4)2CO3>NH4HSO4>NH4Cl | |
| D. | c(S2-):Na2S>NaHS>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2、H2S、C2H4 | B. | H2、CO2、H2S | C. | HCl、CO2、O2 | D. | H2、NO2、CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 立方氮化硼是一种超硬材料,可由:2Mg3B2N4+3O2 $\frac{\underline{\;\;\;\;\;高温,加热\;\;\;\;\;}}{添加剂,催化剂}$6MgO+4BN+2N2制备.
立方氮化硼是一种超硬材料,可由:2Mg3B2N4+3O2 $\frac{\underline{\;\;\;\;\;高温,加热\;\;\;\;\;}}{添加剂,催化剂}$6MgO+4BN+2N2制备.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com