
��07�꽭�վ��� �״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ���ǣ�
��CH3OH(g)+H2O(g)=CO2(g)+3H2(g)�� ��H= + 49��0 kJ?mol��1
��CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g)����H=��192��9 kJ?mol��1
����˵����ȷ���ǣ���
A��CH3OH��ȼ����Ϊ192��9 kJ?mol��1
B����Ӧ���е������仯����ͼ��ʾ
C��CH3OHת���H2�Ĺ���һ��Ҫ��������
D�����ݢ���֪��Ӧ�� CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)�ġ�H>��192��9kJ?mol��1

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
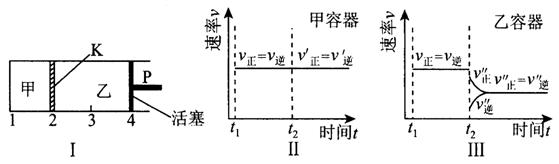
��07�꽭�վ���һ���¶��¿��淴Ӧ��A(s)+2B(g)![]() 2C(g)+D(g)����H<0���ֽ�1mol A��2molB����������У���4 molC��2 mol D�����������У���ʱ���ƻ���P��ʹ�ҵ��ݻ�Ϊ��2����t1ʱ�������ھ��ﵽƽ��״̬(��ͼ1��ʾ������K�����ƶ�)������˵����ȷ���ǣ���
2C(g)+D(g)����H<0���ֽ�1mol A��2molB����������У���4 molC��2 mol D�����������У���ʱ���ƻ���P��ʹ�ҵ��ݻ�Ϊ��2����t1ʱ�������ھ��ﵽƽ��״̬(��ͼ1��ʾ������K�����ƶ�)������˵����ȷ���ǣ���
A�������¶Ⱥͻ���λ�ò��䣬�ڼ����ټ���1molA��2molB���ﵽ�µ�ƽ�����C��Ũ��������C��Ũ�ȵ�2��
B�����ֻ���λ�ò��䣬�����¶ȣ��ﵽ�µ�ƽ��ס�����B���������������
C�������¶Ȳ��䣬�ƶ�����P��ʹ�ҵ��ݻ��ͼ���ȣ��ﵽ�µ�ƽ�������C����������Ǽ���C�����������2��
D�������¶Ⱥ����е�ѹǿ���䣬t2ʱ�ֱ���ס����м���������ĺ����ס����з�Ӧ���ʱ仯����ֱ���ͼ2��ͼ3��ʾ(t1ǰ�ķ�Ӧ���ʱ仯��ʡ��)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com