
| A. | 向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,无CaCO3沉淀产生 | |
| B. | SO2具有漂白性,将过量SO2气体通入紫色石蕊试液时,石蕊试液先变红后褪色 | |
| C. | CO、SO2、NO2都是对大气产生污染的气体,它们的空气中都能稳定存在 | |
| D. | 类比(比较)是研究物质性质的常用办法之一,可预测许多物质的性质.例如:将SO2通入BaCl2溶液不产生沉淀,则SO2通入Ba(NO3)2溶液也不产生沉淀 |
分析 A.碳酸氢钙与碳酸氢钠不反应;
B.二氧化硫不能漂白指示剂;
C.一氧化碳、二氧化硫、二氧化氮有毒,能够在空气中稳定存在;
D.硝酸根离子在酸性环境下具有强的氧化性,能够氧化二氧化硫生成硫酸根离子.
解答 解:A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解生成碳酸氢钙,再向溶液中加入NaHCO3饱和溶液,二者不反应,无CaCO3沉淀产生,故A正确;
B.二氧化硫为酸性氧化物,与水反应生成亚硫酸,将过量SO2气体通入紫色石蕊试液时,石蕊试液变红,故B错误;
C.一氧化碳、二氧化硫、二氧化氮有毒,都能够对大气产生污染的气体,能够在空气中稳定存在,故C正确;
D.将SO2通入BaCl2溶液不产生沉淀,则SO2通入Ba(NO3)2溶液,发生氧化还原反应,生成硫酸根离子,硫酸根离子与钡离子反应生成白色沉淀,故D错误;
故选:AC.
点评 本题考查了元素化合物知识,明确物质的性质及发生的反应是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| 选项 | 实验 | 现象 | 结论 |
| A | 取少量食盐溶于水,加稀硫酸酸化,再滴入淀粉溶液 | 溶液未呈蓝色 | 该食盐中不含有碘酸钾 |
| B | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置 | 下层溶液显紫红色 | Fe3+的氧化性大于I2 |
| C | 向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液 | 均有沉淀 | 蛋白质均发生了变性 |
| D | 将0.1mol•L-1 MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol•L-1CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]< Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 1.20 | 16.21 |
| 2 | 3.00 | 18.90 |
| 3 | 4.50 | 19.49 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
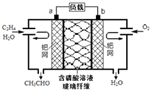 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A. | a电极发生还原反应 | |
| B. | 放电时,每转移2mol电子,理论上需要消耗28g乙烯 | |
| C. | b极反应式为:O2+4e-+2H2O═4OH- | |
| D. | 电子移动方向:电极a→磷酸溶液→电极b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在体积恒定的密闭容器中发生反应N2O4(g)?2NO2(g)△H(△H>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的是( )
在体积恒定的密闭容器中发生反应N2O4(g)?2NO2(g)△H(△H>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的是( )| A. | A、C两点的反应速率:A>C | |
| B. | A、C两点气体的颜色:A深,C浅 | |
| C. | 由状态B到状态A,可以用加热的方法 | |
| D. | A、C两点气体的平均相对分子质量:A>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a mol Na2O2中含有的离子数为4aNA | |
| B. | 100mL 1mol/L NaHCO3溶液中含有0.1NA个HCO3- | |
| C. | 标准状况下,2.24L氟化氢,其分子数为0.1NA | |
| D. | 28g N2和N4的混合气体中含有原子个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、CO32-、SO42-、H+ | B. | K+、AlO2-、H+、Cl- | ||
| C. | Fe3+、K+、OH-、NO3- | D. | Al3+、H+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在101kPa时,1molS完全燃烧生成SO3时所放出的热量,是S的燃烧热 | |
| B. | 吸热反应必须加热才能反应,放热反应不需要加热 | |
| C. | 在101kPa时,1mol S和2mol S的燃烧热相同 | |
| D. | 在稀溶液中,H2SO4和Ba(OH)2完全中和产生1mol水时放出的热量为57.3kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com