
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)。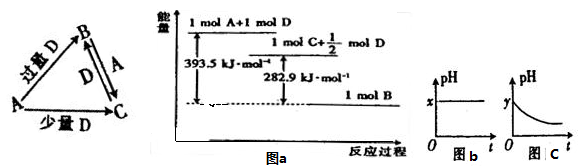
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为 ;
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则
①C的化学式为 ;
②反应B+A→C的离子方程式为 ;
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)。
①若图b符合事实,则D的化学式为 ;
②若图c符合事实,则其pH变化的原因是 (用离子方程式表示);
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出A+D→C的热化学方程式 ;
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:填空题
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下: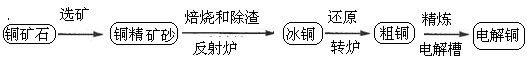
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转化为低价氧化物。该过程中两个主要反应的化学方程式是 、 ,反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是 、 ;
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板是图中电极 (填图中的字母);在电极d上发生的电极反应式为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。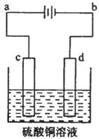
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)向FeCl3溶液中加入a g的铜粉,搅拌使之全部溶解,溶液中一定有的阳离子是_________。可能有的阳离子是 。发生反应的离子方程式为 ;再向其中加入 b g铁粉,充分反应后过滤得滤渣c g,可能发生反应的离子方程式为 。若已知 a>b>c,则 c克滤渣是_________。
(2)鉴别Na2SO3溶液和稀H2SO4。请按要求完成下表:
| 步骤 | 操作 | 现象及结论 |
| 1 | 用甲、乙两支试管分别取两种溶液各少许。 | |
| 2 | 用胶头滴管向甲试管中逐滴滴加BaCl2溶液至过量。 | |
| 3 | 。 | ,则甲是 ,乙是 。 ,则甲是 ,乙是 。 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二硫化亚铁是Li/FeS2电池的正极活性物质,可用水热法合成。FeSO4、Na2S2O3、S及H2O在200℃连续反应24小时,四种物质以等物质的量反应,再依次用CS2、H2O洗涤、干燥及晶化后得到。
(1)合成FeS2离子方程式为 。
(2)用水洗涤时,如何证明S042-己除尽 。
(3)己知1.20gFeS2在O2中完全燃烧生成Fe2O3和SO2气体放出8.52kJ热量,FeS2燃烧反应的热化学方程式为 。
(4)取上述制得的正极材料1.1200g (假定只含FeS一种杂质),在足量的氧气流中充分加热,最后得0.8000g红棕色固体,则该正极材料中FeS2的质量分数(写出计算过程)。
。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14 分)铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlC13(g)+3C(s) ="3AlCl(g)+3CO(g)" △H="a" kJ·mol-1
3AlCl(g)=2Al(l)+AlC13(g) △H="b" kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b 的代数式表示)。
②Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃) 的化学方程式为 。
(2)镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al122+17H2=17MgH2+12Al。得到的混合物Y(17MgH2 +12Al)在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是 。
②在6. 0 mol·L-1 HCl 溶液中,混合物Y 能完全释放出H2。1 mol Mg17 Al12完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2的物质的量为 。
③在0. 5 mol·L-1 NaOH 和1. 0 mol·L-1 MgCl2溶液中, 图8
混合物Y 均只能部分放出氢气,反应后残留固体物质的X-射线衍射谱图如图所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH 溶液中,混合物Y 中产生氢气的主要物质是 (填化学式)。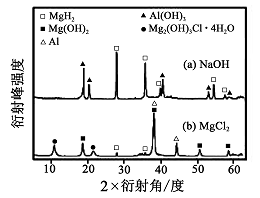
(3)铝电池性能优越,Al-AgO 电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为 。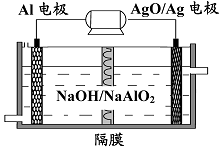
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。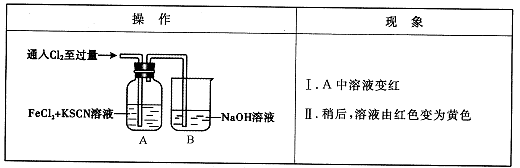
(1)B中反应的离子方程式是____。
(2)A中溶液变红的原因是____。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在 。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象Ⅱ的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为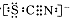
①甲同学认为SCN—中碳元素没有被氧化,理由是 。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是 。
③通过实验证明了SCN—中氮元素转化为NO3-,他的实验方案是____。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(6分) 向1L AlCl3和FeCl3混合溶液中加入2mol /LNaOH溶液300mL时,产生的沉淀量达最大值;继续加入NaOH溶液,沉淀开始溶解,当加入NaOH溶液的总体积达到 350mL时,沉淀不再减少,求原溶液中FeCl3的物质的量浓度(需写出解题过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(7分)现有22g Mg、Al、Zn、Fe多种活泼金属粉末的混合物与200mL含有一定质量的20%硫酸溶液恰好完全反应,得到无水盐70g,求(要求写出计算过程)
(1)硫酸溶液的质量?
(2)生成的气体体积(标准状况)?
(3)硫酸物质的量浓度?
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如图所示的装置进行实验。通入SO2气体,将带火星的木条插入试管C中的溶液上方,木条复燃。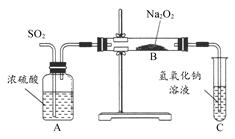
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是 。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3: 。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案: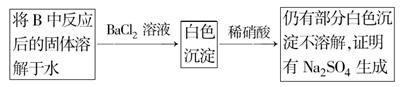
上述方案是否合理? 。请简要说明两点理由:① ;② 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com