
 碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.请回答下列问题:
碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.请回答下列问题:| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、若反应开始时容器体积为2L,则v(C)=0.4mol/(L?min) |
| B、若在恒压绝热条件下反应,平衡后n(C)<1.6mol |
| C、若2min后,向容器中再投入等物质的量A、C,B的转化率不变 |
| D、若该反应在恒温恒容下进行,放出热量将增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
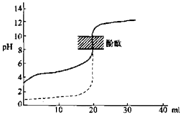 下列说法正确的是( )
下列说法正确的是( )| A、0.1 mol?L-1的Na2S溶液中c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| B、如图是用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和体积均相同的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线 |
| C、HA是酸性略强与醋酸的弱酸,在0.1 mol?L-1 NaA溶液中,离子浓度关系可能是c(Na+)>c(A-)>c(H+)>c(OH-) |
| D、pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:

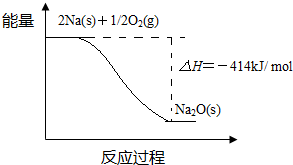
查看答案和解析>>
科目:高中化学 来源: 题型:
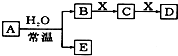 由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图所示的转化关系(部分生成物和反应条件略去).
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图所示的转化关系(部分生成物和反应条件略去).查看答案和解析>>
科目:高中化学 来源: 题型:
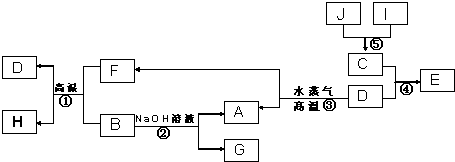
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾可用作除去污水中悬浮颗粒的混凝剂 |
| B、棉花、羊毛、腈纶和涤纶都属于合成纤维 |
| C、使用青霉素前一定要进行皮肤敏感试验 |
| D、利用油脂在碱性溶液中的水解可制取肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L NO和22.4L O2的混合,混合气体中含有的氧原子数为3NA | ||||
| B、0.012kg 13C中,含中子数为7NA | ||||
| C、25℃时,1L pH=13的氢氧化钡溶液中含有0.1NA个氢氧根离子 | ||||
D、在反应3SiO2+6C+2N2
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com