
铝和硅均能与强碱溶液反应,离子方程式分别为:?
2Al+2OH-+2H2O====2![]() +3H2↑?
+3H2↑?
Si+2OH-+H2O====![]() +2H2↑?
+2H2↑?
现有一铁、硅、铝的混合物13.0 g,当与足量盐酸反应时,生成标准状况下的氢气11.2 L;若将等质量的混合物与足量的NaOH溶液反应时,生成的H2在标准状况下也是11.2 L。求原混合物中各组分的质量。?
13.0 g原混合物中Fe、Si、Al的质量分别为:4.31 g、1.08 g和7.62 g。?
设13.0 g混合物中,Fe、Si、Al的物质的量分别是x mol、y mol、z mol,当与足量HCl(aq)混合时,Si不参加反应。
2Al+6HCl====2AlCl3+3H2↑
2 mol 67.2 L
z mol 33.6?z? L
Fe+2HCl====FeCl2+H2↑
1 mol 22.4 L
?x mol 22.4?x? L
(横线上为求出数值,下同)
当与NaOH(aq)混合时,Fe不参加反应:
2Al ~ 3H2↑ Si ~ 2H2↑
2 mol 67.2 L 1 mol 44.8 L
z mol 33.6z L? y mol 44.8y L
由题意得:
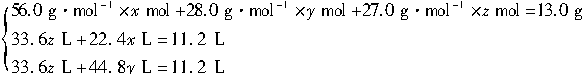 解得:x=0.076 9、?y=0.038 5、?z=0.282
解得:x=0.076 9、?y=0.038 5、?z=0.282
?m(Fe)=56.0 g· mol-1×0.076 9 mol=4.31 g
?m(Si)=28.0 g· mol-1×0.038 5 mol=1.08 g
?m(Al)=27.0 g· mol-1×0.282 mol=7.62 g


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
![]() ?
?
![]() ?
?
现有一铁、硅、铝的混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com