
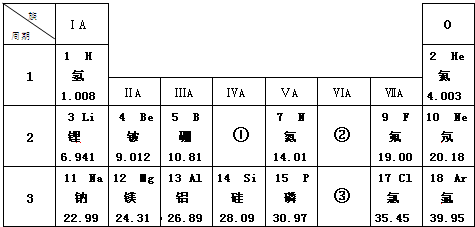
 ,它在表中位置是③.(填“①”、“②”或“③”)该原子的最外层电子数为6
,它在表中位置是③.(填“①”、“②”或“③”)该原子的最外层电子数为6分析 (1)F元素是9号元素,原子核外电子数等于原子序数;第三周期的金属元素有Na、Mg、Al;
(2)周期数=电子层数、主族族序数=最外层电子数;
(3)原子序数为12的元素原子为Mg,属于金属元素,最外层电子数为2,易失去最外层2个电子形成阳离子.
解答 解:(1)F元素是9号元素,原子核外电子数等于原子序数,F原子核外电子数为9,第三周期的金属元素有Na、Mg、Al三种,故答案为:9;3;
(2)某元素的原子结构示意图为 ,原子核外有3个电子层,最外层电子数为6,处于第三周期VI族,为表中③的位置,故答案为:③;6;
,原子核外有3个电子层,最外层电子数为6,处于第三周期VI族,为表中③的位置,故答案为:③;6;
(3)原子序数为12的元素原子为Mg,属于金属元素,最外层电子数为2,易失去最外层2个电子形成Mg2+离子,故答案为:失;Mg2+.
点评 本题考查结构性质位置关系应用,比较基础,有利于基础知识的巩固.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ②③④⑤ | C. | ②③⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
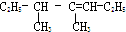 4,5-二甲基-3-庚烯
4,5-二甲基-3-庚烯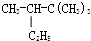 2,2,3一三甲基戊烷
2,2,3一三甲基戊烷查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 等物质的量的MgCl2、Ba(OH)2和HC1溶液混合:Mg2++2OH-=Mg(OH)2↓ | |
| C. | 铜溶于稀硝酸中:Cu+4H++2NO${\;}_{3}^{-}$═Cu2++2NO2↑+2H2O | |
| D. | FeBr2溶液中通入少量的C12:2Fe2++C12=2Fe3++2C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com