
某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4 ·4H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 | 初始 pH | 废水样品 体积/mL | 草酸溶液 体积/mL | 蒸馏水 体积/mL |
| ① | 4 | | 10 | 30 |
| ② | 5 | 60 | 10 | |
| ③ | | 60 | | 20 |
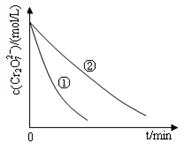
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 取_______________________________代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后 若溶液中的Cr2O72-浓度____________________________则假设一成立; 若溶液中的Cr2O72-浓度____________________________则假设一不成立; |
(1)实验
编号初始
pH废水样品
体积/mL草酸溶液
体积/mL蒸馏水
体积/mL① 60 ② 30 ③ 4或5 20
(2)溶液的pH对该反应的速率有影响(3)Al3+起催化作用;SO42-起催化作用(4)等物质的量K2SO4·Al2(SO4)3·24H2O;大于实验①中的Cr2O72-浓度;等于实验①中的Cr2O72-浓度
解析试题分析:(1)①②中PH不同,是探究PH对速率的影响;则②③是探究不同浓度时草酸对速率的影响,故答案为实验
编号初始
pH废水样品
体积/mL草酸溶液
体积/mL蒸馏水
体积/mL① 60 ② 30 ③ 4或5 20
(2)由实验①②表明溶液pH越小,反应的速率越快,所以溶液pH对该反应的速率有影响(3)根据铁明矾[Al2Fe(SO4)4?24H2O]组成分析,Al3+起催化作用;SO42-起催化作用;(4)要证明Fe2+起催化作用,需做对比实验,再做没有Fe2+存在时的实验,所以要选K2SO4?Al2(SO4)3?24H2O;用等物质的量K2SO4?Al2(SO4)3?24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验,反应进行相同时间后,若溶液中c(Cr2O72-)大于实验①中c(Cr2O72-),则假设一成立;若两溶液中的c(Cr2O72-)相同,则假设一不成立;
考点:探究影响化学反应速率的因素


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:计算题
(7分)把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)=nZ(g)+6W(g)。2 min时生成0.3 mol W,此时测知以Z的浓度变化表示的反应速率为0.05 mol·L-1·min-1。试计算:
(1)前2 min内用X的浓度变化表示的平均反应速率为 mol·L-1·min-1。
(2)计算n值和2 min末时Y的浓度(写出必要的计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
| 实验编号 | 温度 | 时间 | 0 | 10 | 20 | 40 | 50 |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | | 0.15 |

 4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2%H2O2溶液 | 无 |
| ② | 10 mL 5%H2O2溶液 | 无 |
| ③ | 10 mL 5%H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ | 10 mL 5%H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ | 10 mL 5%H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |



查看答案和解析>>
科目:高中化学 来源: 题型:实验题
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,并探究其分解反应平衡常数。反应的化学方程式: 2NH3(g)+CO2(g)  NH2COONH4(s)。请按要求回答下列问题:
NH2COONH4(s)。请按要求回答下列问题:
(1)请在下图1方框内画出用浓氨水与生石灰制取氨气的装置简图。
(2)制备氨基甲酸铵的装置如下图2所示。生成的氨基甲酸铵小晶体悬浮在四氯化碳中。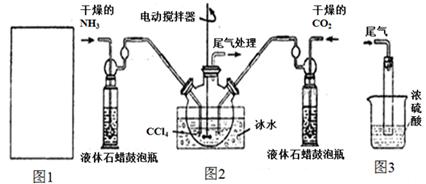
①从反应后的混合物中分离出产品的实验方法是_____________(填操作名称)。
②上图3中浓硫酸的作用是_______________________________________。
(3)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡。实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某学生为了探究锌与盐酸反应过程中速率变化。在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下面是某研究小组研究的关于不同催化剂对H2O2分解反应的催化效率。
| 催化剂(0.1g) | 活性炭 | FeCl3 | KI | MnO2颗粒状 | MnO2粉末状 |
| 前15s产生氧气的量(ml) | 5 | 11 | 7 | 8 | 11 |
| 前30s产生氧气的量(ml) | 8 | 16 | 11 | 11 | 21 |
| 前45s产生氧气的量(ml) | 11 | 20 | 15 | 18 | 35 |
| 前60s产生氧气的量(ml) | 15 | 24 | 20 | 26 | 49 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
(原创)已知:HCl为强酸,下列对比实验不能用于证明CH3COOH为弱酸的是
| A.对比等浓度的两种酸的pH |
| B.对比等浓度的两种酸,与相同大小镁条反应的初始速率 |
| C.对比等浓度、等体积的两种酸,与等量NaOH溶液反应后放出的热量 |
| D.对比等浓度、等体积的两种酸,与足量Zn反应,生成H2的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
A.将25℃纯水加热至95℃时,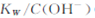 增大 增大 |
B.将pH=11的Na2CO3溶液加水稀释, 增大 增大 |
| C.室温下,pH=a的盐酸与pH=b的氨水等体积混合后pH=7,则a+b="14" |
| D.0.1mol·L-酸HA与0.1mol·L-NaOH溶液等体积混合后pH>7,则 |
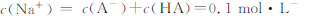
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com