
| A. | 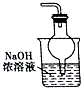 用如图装置除去乙酸乙酯中混有的少量乙酸 | |
| B. | 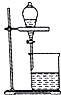 用如图装置可直接分离溴苯和溴 | |
| C. | 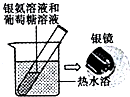 用如图装置验证葡萄糖分子有还原性 | |
| D. | 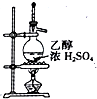 用如图装置制取乙烯 |
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑤ | ⑩ | ⑥ | |||||
| 3 | ① | ③ | ④ | ⑧ | ⑨ | ⑦ | ||
| 4 | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验现象 | 解释与结论 | |
| A | 向铜和稀硫酸的混合物中加入无色溶液,溶液逐渐变成蓝色,铜逐渐溶解 | 该无色溶液一定是硝酸 |
| B | 将某气体通入品红溶液中,品红溶液颜色 | 该气体一定是SO2 |
| C | SO2气体通过Ba(NO3)2溶液中,溶液出现浑浊现象 | 说明有BaSO3沉淀生成 |
| D | 向NaHCO3溶液中滴加酚酞试液,加热时溶液由淡红色变为红色,冷却后溶液由红色变为淡红色 | 说明HCO3在水溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol丙烯酸中含有双键的数目为0.2NA | |
| B. | 丙烯和1-丁烯组成的21g混合气体中氢原子的个数为3NA | |
| C. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| D. | 1mol羟基与1mol氢氧根离子所含电子数均为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
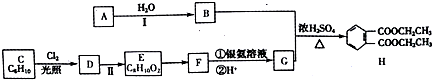
 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
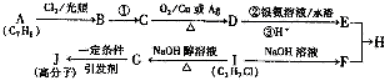
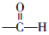 ,发生反应①的条件是氢氧化钠水溶液、加热.
,发生反应①的条件是氢氧化钠水溶液、加热. .
.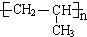 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
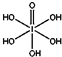 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com