
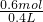 =1.5mol/L;
=1.5mol/L;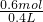 =1.5mol/L;
=1.5mol/L;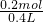 =0.5mol/L;
=0.5mol/L;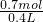 =1.75mol/L;
=1.75mol/L; 结合溶液混合前后溶质的物质的量不变计算溶液中各粒子的物质的量浓度.
结合溶液混合前后溶质的物质的量不变计算溶液中各粒子的物质的量浓度.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省安庆九中高一(上)期中化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com