
 有些食物中铁元素含量非常丰富,其中非血红素铁是其存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.
有些食物中铁元素含量非常丰富,其中非血红素铁是其存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.分析 (1)Fe原子核外电子排布式为1s22s22p63s23p63d64s2,失去4s能级2个电子及3d能级1个电子形成Fe3+;
(2)中心原子或离子含有空轨道,配体含有孤对电子;Fe(CO)5为熔沸点很低,易溶于非极性溶剂,应属于分子晶体;
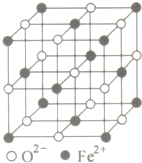
(3)单质铁中铁原子采用钾型模式堆积,原子空间利用率为68%,晶胞结构为体心立方密堆积;
(4)乙醛中甲基中C原子杂化轨道数目为4,醛基中C原子杂化轨道数目为3;单键为σ键,双键含有1个σ键;
(5)FeO晶体离子为1:1型结构,Fe2+的配位数与O2-的配位数相等;
根据均摊法计算晶胞中Fe2+、O2-数目,再计算晶胞质量,根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)Fe原子核外电子排布式为1s22s22p63s23p63d64s2,失去4s能级2个电子及3d能级1个电子形成Fe3+,Fe3+的电子排布式为:1s22s22p63s23p63d5,
故答案为:1s22s22p63s23p63d5;
(2)配合物 Fe(CO)5 中Fe原子含有空轨道,CO含有孤对电子,配位体是CO,Fe(CO)5为熔沸点很低,易溶于非极性溶剂,应属于分子晶体,
故答案为:CO;分子晶体;
(3)单质铁中铁原子采用钾型模式堆积,原子空间利用率为68%,晶胞结构为体心立方密堆积,Fe原子配位数为8,
故答案为:8;
(4)乙醛中甲基中C原子杂化轨道数目为4,醛基中C原子杂化轨道数目为3,碳原子分别为sp3、sp2杂化;单键为σ键,双键含有1个σ键,1mol 乙醛分子中含有6molσ键,含有的σ键数目为6×6.02×1023,
故答案为:sp3、sp2;6×6.02×1023;
(5)FeO晶体离子为1:1型结构,O2-的配位数为6,Fe2+的配位数与O2-的配位数相等也是6,晶胞中Fe2+数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则O2-数目也是4,晶胞质量为4×$\frac{72}{{N}_{A}}$g,该晶胞边长为b cm,则该晶体密度为4×$\frac{72}{{N}_{A}}$g÷(b cm)3=$\frac{288}{{b}^{3}×{N}_{A}}$g/cm3,
故答案为:6;$\frac{288}{{b}^{3}×{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、配位键、晶体类型与性质、化学键、晶胞结构及计算等,熟记中学常见晶胞结构,掌握均摊法进行晶胞有关计算.


科目:高中化学 来源: 题型:选择题
| A. | 22.4LCH4和CH3Cl的混合物所含有的分子数目为NA | |
| B. | 1mol过氧化氢分子中共用电子对数为3NA | |
| C. | 用惰性电极电解1 L浓度均为2 mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2 NA个电子转移时,阴极析出6.4g金属 | |
| D. | 0.1mol Na2CO3•10H2O在晶体中或溶液中,含有的CO32-离子均小于0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | K闭合时,c电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42- | |
| B. | 当电路中转移0.4mol电子时,I中消耗的H2SO4为0.2 mol | |
| C. | K闭合时,II中SO42-向c电极迁移 | |
| D. | K闭合一段时间后,II可单独作为电源,d电极为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
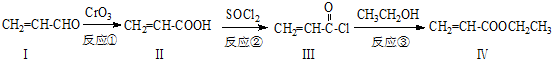
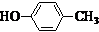 也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为
也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为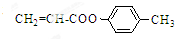 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向AgNO3溶液中加入过量氨水 | 由白色沉淀生成 | Ag+与NH3•H2O不能共存 |
| B | 向2ml2%的CuSO4溶液中加入0.5mol/L的NaOH溶液,震荡后低价几滴M溶液,加热 | 未出现砖红的沉淀 | M不属于醛类物质 |
| C | 向NaAlO2溶液中滴加饱和NaHCO3溶液 | 由白色沉淀生成 | 验证两者都发生了水解反应,且相互促进 |
| D | 向草酸溶液中低价几滴紫色酸性KmnO4溶液,震荡 | 溶液紫色褪去 | 草酸具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种液体都可以使干燥的布条褪色 | |
| B. | 两种液体都可以使干燥的蓝色石蕊试纸变红 | |
| C. | 用这两种液体都可给自来水消毒 | |
| D. | 分别向这两种液体中投人几颗金属锌粒均有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的BaCl2溶液中:K+、Na+、OH-、NO3- | |
| B. | 使甲基橙变红的溶液中:Ca2+、NH4+、CH3COO-、Cl- | |
| C. | 无色透明的溶液中:Fe2+、SO42-、NO3-、Na+ | |
| D. | 由水电离出的c(H+)=10-12 mol•L-1的溶液中:Mg2+、K+、Br-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L氧气含有的原子数目为NA | |
| B. | 锌从盐酸中置换出1 mol H2,转移的电子数目为NA | |
| C. | 4.4 g 二氧化碳含有的分子数目为0.1 NA | |
| D. | 1 mol/L CaCl2溶液中含有的氯离子数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com