
| c(Na+) |
| c(HCO3-) |
| A、①④ | B、②⑤ | C、①③ | D、②④ |
| c(Na+) |
| c(HCO3-) |


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
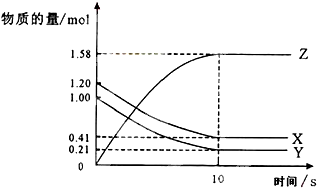
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
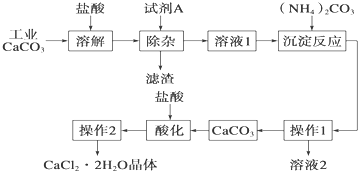
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
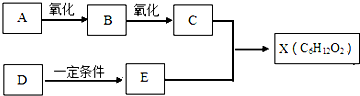
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、吸液时左手拿洗耳球右手持移液管;放液时应将移液管倾斜放入垂直放置的容器中 |
| B、用碱式滴定管量取23.10mL 0.20mol?L-1高锰酸钾溶液 |
| C、用10mL量筒量取5.2mL稀硫酸,仰视时实际量得的液体体积大于5.2mL |
| D、钠、钾、白磷均应保存在煤油中,取用它们时要用镊子夹取 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com