
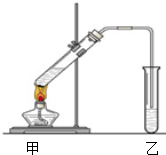
 (1)配置混合溶液时,加入试剂的正确顺序是A(填“A”或“B”);
(1)配置混合溶液时,加入试剂的正确顺序是A(填“A”或“B”);分析 (1)类比浓硫酸的稀释进行判断;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,乙醇溶解,碳酸钠与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;
(3)分离互不相溶的液体,可用分液的方法分离;
(4)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应.
解答 解:(1)浓硫酸的稀释是将浓硫酸加入水中,边加边搅拌,迁移到此处,即将浓硫酸加入到乙醇中,边摇动试管边慢慢加入浓硫酸和醋酸,所以正确是A,
故答案为:A;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,目的是除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层,所以B正确,
故答案为:B;
(3)分离乙酸乙酯时先将盛有混合物的试管充分振荡,让饱和碳酸钠溶液中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,静置分层后取上层得乙酸乙酯,
故答案为:分液;
(4)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,同时该反应可逆,反应的化学方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O.
点评 本题考查乙酸乙酯的制备,注意实验混合液的配制、饱和碳酸钠溶液的作用以及酯化反应的机理,本题难度中等,侧重于考查学生的实验能力和对基础知识的应用能力.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入溴水中,观察溴水是否褪色 | |
| B. | 通入酸性高锰酸钾溶液中,观察颜色变化 | |
| C. | 点燃,检验燃烧产物 | |
| D. | 点燃,观察火焰明亮程度及产生黑烟量的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙酸乙酯是重要的有机物,某化学兴趣小组对乙酸乙酯的制取进行探究活动.
乙酸乙酯是重要的有机物,某化学兴趣小组对乙酸乙酯的制取进行探究活动.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
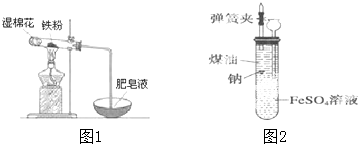 铁是日常生活中用途最广、用量最大的金属材料.
铁是日常生活中用途最广、用量最大的金属材料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
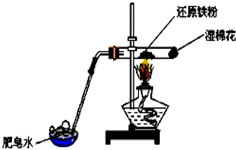
| A. | 实验时,试管口应高于试管底 | |
| B. | 加热时试管内铁粉红热,点燃肥皂泡可听到爆鸣声 | |
| C. | 反应的化学方程式为:2Fe+3H2O(g) $\frac{\underline{\;\;△\;\;}}{\;}$ Fe2O3+3H2 | |
| D. | 实验结束后如果固体仍为黑色,说明原反应没有发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
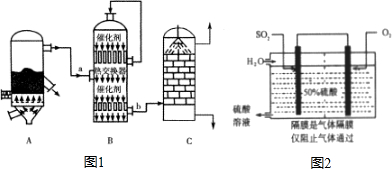 硫酸和纯碱都属于工业上常用的“三酸两碱”.回答下列问题:
硫酸和纯碱都属于工业上常用的“三酸两碱”.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com