
| 温度/℃ | 25 | T1 | T2 |
| 水的离子积常数 | 1.0×10-14 | α | 1.0×10-12 |
| 1×10-3mol/L×0.1L-1×10-4mol/L×0.9L |
| 0.1L+0.9L |
| 50mL |
| 100mL+50mL |
| 0.01 |
| 3 |
| 0.01 |
| 3 |
| 0.00503 |
| 3 |
| c(NH4+)c(OH-) |
| c(NH3?H2O) |
| ||
|


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
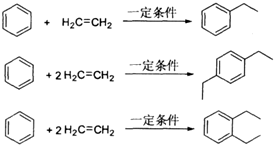
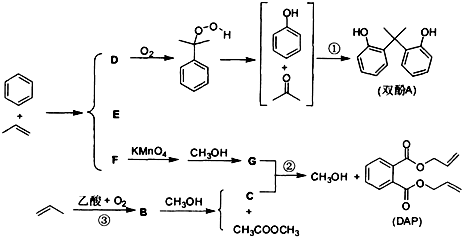
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸、CuSO4?5H2O、纯碱 |
| B、硫酸氢钠、空气、纯碱 |
| C、氧化铁、明矾、熟石灰 |
| D、硝酸、食盐水、烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用、环形玻璃搅拌棒进行搅拌、酸和碱正好反应、取2-3 次的实验平均值,以达到良好的实验效果 |
| B、溶质的溶解度越大,溶液的浓度越高,溶剂的蒸发速度越快,溶液的冷却速度越快,析出的晶体就越细小 |
| C、吸滤操作中,吸滤完毕或中途需停止吸滤时,应注意先拆下连接抽气泵和吸滤瓶的橡皮管,然后关闭水龙头,以防倒吸 |
| D、为验证盐桥的作用,在两个烧杯中分别盛适量硫酸亚铁铵溶液稀的酸性高锰酸钾溶液,分别插入石墨棒用导线与电流计相连,然后用装有K2SO4饱和溶液的琼脂的U型管两端插入两个烧杯中,电流计偏转,一段时间后高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH |
| B、中和滴定时,右手控制滴定管活塞,左手振荡锥形瓶,眼睛注视锥形瓶中溶液颜色的变化 |
| C、pH试纸是将试纸用多种酸碱指示剂的混合液浸透,经晾干后制成的 |
| D、纸层析法分离铁离子和铜离子实验中,展开剂的成份为蒸馏水与丙酮 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com