
| A. | 常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为l×10-24,该溶液中一定可以大量存在K+、Na+、AlO-2、SO2-4 | |
| B. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| C. | 镍镉可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2$?_{放电}^{充电}$Cd(OH)2+2Ni(OH)2+2H2O,充电时阳极反应为:Ni(OH)2+OH-+e-═NiO(OH)+H2O | |
| D. | 某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O.已知As是产物之一,则该反应配平后H2O的化学计量数为6 |
分析 A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液为强酸性或强碱性溶液,能和氢离子或氢氧根离子反应的离子不能大量共存;
B.过氧化钠中阴离子为过氧根离子,1mol Na2O和Na2O2的混合物中含有的阴、阳离子的物质的量为3mol;
C.充电时阳极失电子发生氧化反应;
D.根据As、Sn元素化合价及电子转移守恒可知,H3AsO3是氧化剂,被还原为As,SnCl2是还原剂被氧化为H2SnCl,再根据质量守恒、电子守恒书写方程式.
解答 解:A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液为强酸性或强碱性溶液,强酸性条件下,偏铝酸根离子不能大量共存,故A错误;
B.1mol Na2O和Na2O2的混合物中含有2mol钠离子和1mol阴离子,总共含有3mol阴阳离子,含有的阴、阳离子总数是3NA,故B正确;
C.根据反应原理可知,镍镉碱性充电电池充电时阳极失去电子发生氧化反应,其电极反应为:Ni(OH)2-e-+OH-═NiOOH+H2O,故C正确;
D.As是反应物之一,根据As、Sn元素化合价及电子转移守恒可知,H3AsO3是氧化剂,被还原为As,SnCl2是还原剂被氧化为H2SnCl,所以反应方程式为12HCl+3SnCl2+2H3AsO3═3H2SnCl6+2As+6H2O,所以配平后H2O的化学计量数为6,故D正确;
故选A.
点评 本题考查了离子共存,电极反应式的书写已经氧化还原反应方程式的配平等,易错选项是A,会根据c(H+)和c(OH-)的乘积确定溶液中的溶质性质,为易错点.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
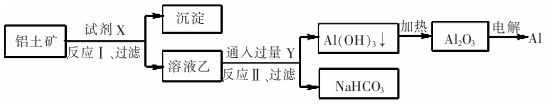
| A. | 试剂X为稀硫酸 | |
| B. | 反应Ⅱ中生成Al(OH)3的反应为:CO2+AlO2-+2H20=Al(OH)3↓+HCO3一 | |
| C. | 结合质子( H+)的能力由强到弱的顺序是Al02->CO32->OH- | |
| D. | Al2O3熔点很高,工业上还可采用电解熔融AICl3冶炼Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
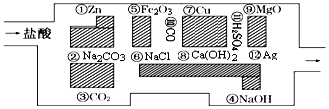
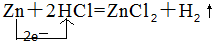 .其中氧化剂是HCl,还原剂是Zn.
.其中氧化剂是HCl,还原剂是Zn.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
| Ⅰ | 7.4 | 40.00 | 1.68 |
| Ⅱ | 14.8 | 40.00 | 3.36 |
| Ⅲ | 22.2 | 40.00 | 1.12 |
| Ⅳ | 37.0 | 40.00 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.
;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.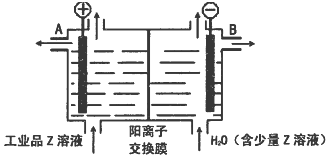
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 四种主族元素的性质或结构信息如下:
四种主族元素的性质或结构信息如下:| 元素编号 | 相关信息 |
| X | 地壳中含量最大的金属元素;元素最高价为+3价. |
| Y | 原子最外层电子数是电子层数的2倍,最外层电子数是X最外层电子数的2倍. |
| Z | 同周期主族元素中原子半径最小,常温下单质呈液态. |
| M | 能从海水中提取的金属元素,单质可在氮气或二氧化碳中燃烧. |
 ;上述元素最高价氧化物对应的水化物碱性最强的是(写分子式)Mg(OH)2(元素用元素符号表示,下同!).
;上述元素最高价氧化物对应的水化物碱性最强的是(写分子式)Mg(OH)2(元素用元素符号表示,下同!).查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ③④⑤ | C. | ①②④⑤ | D. | ②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com