
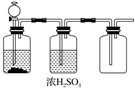
| A. | FeS和稀H2SO4 | B. | 加热NaCl和浓H2SO4制HCl | ||
| C. | 大理石和稀盐酸 | D. | MnO2和浓盐酸 |
分析 由装置图可知,在常温下反应生成的气体可用浓硫酸干燥,且用向上排空法收集气体,说明气体的密度比空气大,以此解答该题.
解答 解:A.FeS和稀H2SO4反应生成硫化氢气体,具有还原性,不能用浓硫酸干燥,故A错误;
B.装置不能加热,则不能用于制备氯化氢,故B错误;
C.大理石和稀盐酸生成二氧化碳,可用浓硫酸干燥,且二氧化碳密度比空气大,可用向上排空法收集,故C正确;
D.二氧化锰和浓盐酸需要加热条件下制备氯气,而本题装置不能加热,故D错误.
故选C.
点评 本题考查常见气体的干燥和收集,为高频考点,侧重于学生的分析、实验能力的考查,做题时要充分考虑物质的性质,认真分析实验装置图的特点,从而做出正确判断.


科目:高中化学 来源: 题型:选择题
 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).下列有关说法不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池).下列有关说法不正确的是( )| A. | 放电时正极反应为:NiOOH+H2O+e-=Ni(OH)2+OH- | |
| B. | 电池的电解液可为KOH溶液 | |
| C. | 充电时负极反应为:MH+OH-=M+H2O+e- | |
| D. | MH是一类储氢材料,其氢密度越大,电池的能量密度越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
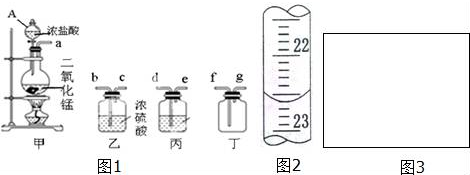
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O | |
| B. | 0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-=2BaSO4+AlO2-+2H2O | |
| C. | 向NaHCO3溶液中滴加盐酸:CO32-+2H+=H2O+CO2↑ | |
| D. | 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸钠的水解反应:CH3COO-+H2O═CH3COOH+OH- | |
| B. | 碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 苯酚钠溶液与过量二氧化碳反应:C6H5O-+CO2+H2O═C6H5OH+CO32- | |
| D. | 稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-═3 Fe3++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
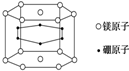
| A. | 22% | B. | 70% | C. | 66.7% | D. | 33.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com