
分析 依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{Vm}$计算解答,摩尔质量以g/mol为单位,数值上与相对分子质量相等;
解答 解:摩尔质量以g/mol为单位,数值上与相对分子质量相等,氨气相对分子质量为17,则摩尔质量为17g/mol;
3.4g NH3所含氢原子数:$\frac{3.4g}{17g/mol}$×3×NA=0.6NA;
设VL的CH4所含氢原子数相同与3.4g NH3所含氢原子数相等,则:
$\frac{V}{22.4L/mol}$×4=0.6mol,解得V=3.36L;
故答案为:17g/mol; 0.6NA;3.36L.
点评 本题考查了以物质的量为核心的计算公式,明确以物质的量为核心计算公式是解题关键,注意氨气、甲烷的结构.


科目:高中化学 来源: 题型:选择题
| A. | 22.4LO2中所含氧气分子计量为1摩尔 | |
| B. | 1mol氧含6.02×1023个O2 | |
| C. | 摩尔是国际科学界建议采用的一种物理量 | |
| D. | 摩尔是物质的量的单位,简称摩,符号为mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质类别 | 酸 | 碱 | 盐 | 金属氧化物 | 非金属氧化物 |
| 化学式 | ①HCl ②H2SO4、H2CO3、H2SO3、H2S | ③NaOH、KOH ④Ba(OH)2 | ⑤Na2SO4 ⑥Na2CO3、Na2SO4、Na2SO3、Na2S | ⑦Na2O | ⑧CO2 ⑨H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
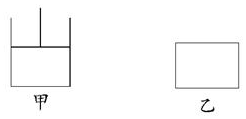 如图,有甲、乙两容器,甲保持恒压,乙保持恒容,分别向其中充入1mol A、3mol B发生可逆反应:A(g)+3B(g)?2C(g)+D(s),下列说法正确的是( )
如图,有甲、乙两容器,甲保持恒压,乙保持恒容,分别向其中充入1mol A、3mol B发生可逆反应:A(g)+3B(g)?2C(g)+D(s),下列说法正确的是( )| A. | 当乙中混合气体总质量不再变化时即达到化学平衡 | |
| B. | 达平衡时用A表示反应速率时,v(甲)<v(乙) | |
| C. | 由于容器甲的容积在不断变化,故从反应开始到平衡所需时间比容器乙要长 | |
| D. | 达到平衡时,甲所需时间短,但两容器中A的转化率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>D>C | B. | 原子序数 D>C>B>A | ||
| C. | 离子半径 C3->D->B+>A2+ | D. | 单质的还原性 A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 (1)已知
(1)已知查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HSO3与足量的2 mol/L硫酸溶液混合微热,产生的刺激性气味的气体是NH3 | |
| B. |  用如图所示装置探究铜丝与过量浓硫酸的反应,为确认CuSO4生成,向①中加水,观察颜色 | |
| C. | 取适量铁粉与一定量的稀硝酸恰好完全反应,体现酸性的硝酸与体现氧化性的硝酸的物质的量之比为3:1 | |
| D. | 电解熔融氯化铝制备金属铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com