
A.砷元素的最高化合价为+3
B.砷元素是第四周期的主族元素
C.砷原子的第3电子层含有18个电子
D.砷的氧化物的水溶液呈强碱性
科目:高中化学 来源: 题型:013
已知元素砷(As)的原子序数为33,下列叙述正确的是
[ ]
A.砷元素的最高化合价为+3
B.砷元素是第3同期的主族元素
C.砷原子的第3个电子层含18个电子
D.砷的氧化物的水溶液呈强碱性
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:021
A.砷元素的最高化合价为+3
B.砷元素是第四周期的主族元素
C.砷原子的第3电子层含有18个电子
D.砷的氧化物的水溶液呈强碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
A.砷元素的最高化合价为+4
B.砷元素是第四周期的主族元素
C.砷原子的第3电子层含有8个电子
D.砷的氧化物的水溶液呈弱碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)随着人们生活质量的提高,不仅室外的环境安全为人们所重视,室内的环境安全和
食品安全也越来越为人们所关注。甲醛是室内主要空气污染物之一(其沸点是―19.5
℃),甲醇是“假酒”中的主要有害物质(其沸点是64.65℃),甲醇的沸点明显高
于甲醛的主要原因是 ;甲醛分子中C的杂化方式为 ,分
子中共有 个π键。
(2)砷化镓属于第三代半导体,它能直接将电能转化为光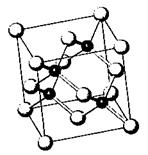 能。已知砷化镓的晶胞结构如
能。已知砷化镓的晶胞结构如
右图。是回答下列问题:
① 下列说法正确的是 (选填序号)
A.砷化镓晶胞结构与NaCl相同
B.第一电离能:As>Ga
C.电负性:As>Ga
D.砷和镓都属于p区元素
② Ga的核外电子排布式为 ;
③ 砷化镓是将(CH3) 3Ga和AsH3用MOCVD方法制备得到,该反应在700℃进行,
反应的方程式为 ;(CH3) 3Ga中碳镓键之间键角为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com