
| 实 验 要 求 | 试剂及方法 |
| 除去KI中少量I2 | |
| 鉴别Na2CO3和K2CO3 | |
| 鉴别 SO2和CO2气体 | |
| 判断CH4中是否含有C2H4 | |
| 证明NH3.H2O溶液呈碱性 |
| 实 验 要 求 | 试剂及方法 |
| 除去KI中少量I2 | C |
| 鉴别Na2CO3和K2CO3 | D |
| 鉴别 SO2和CO2气体 | B |
| 判断CH4中是否含有C2H4 | E |
| 证明NH3.H2O溶液呈碱性 | A |


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
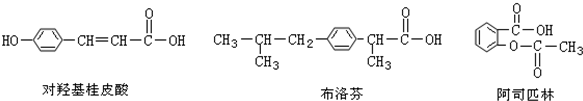
| A、使用FeCl3溶液和稀硫酸可以鉴别这三种有机物 |
| B、三种有机物苯环上的氢原子若被氯原子取代,其一氯代物只有二种 |
| C、将等物质的量的三种物质加入氢氧化钠溶液中,对羟基桂皮酸消耗氢氧化钠最多 |
| D、都能发生水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol CH3+(碳正离子)中含有电子数为10NA |
| B、用石墨电极电解氯化铜溶液时,若阴极增重64 g,则电路中转移的电子数为2NA |
| C、常温常压下,22.4 L乙烷中含有的共价键数为7NA |
| D、在密闭容器中,1molN2与3molH2在一定条件下充分反应,生成氨气的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12.0g熔融的NaHSO4中含有的阳离子数为0.1NA |
| B、常温下,5.6g Fe投入到足量浓硝酸中,转移电子数为0.3NA |
| C、2mol SO2和1mol O2在一定条件下充分反应后,所得混合气体的分子数大于2NA |
| D、足量的锌与一定量的浓硫酸反应生成1mol气体时,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用分液漏斗进行分液操作时,先打开分液漏斗旋塞,使下层液体慢慢流出,待下层液体完全流出后,关闭旋塞,上层液体再从上面倒出 |
| B、用玻璃棒蘸取新制氯水,滴在pH 试纸上,然后与比色卡对照,可测定新制氯水的pH 值 |
| C、中和滴定实验中,如用于盛放待测溶液的锥形瓶洗净后未干燥,不影响测定结果 |
| D、检验火柴头中的氯元素,可把燃尽的火柴头浸泡在少量水中,片刻后取少量溶液于试管中,滴加硝酸银溶液和稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 浓度(mol/L) | 时间(min) | |||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | |||
| 1 | 温 度 |
8000C | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 8000C | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
| 3 | 8000C | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 | |
| 4 | 8200C | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一种反应物 |
| B、催化剂 |
| C、起导热作用 |
| D、增大镁与水分子接触机会 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com