
| A. | F2O | B. | CO2 | C. | ClO2 | D. | CN- |
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 结论 |
| A | Ag2CO3白色悬浊液中滴加少量Na2S溶液,出现黑色沉淀 | Ksp(Ag2S)>Ksp(Ag2CO3) |
| B | 向某溶液中加入氯化钡溶液,产生白色沉淀,再加入过量的稀盐酸,沉淀不溶解 | 该溶液中一定含有SO42- |
| C | 向苯酚浊液中滴加Na2CO3溶液,浊液变澄清 | CO32-结合质子的能力比C6H5O-强 |
| D | 向溶液X中加入Na2O2粉末,出现红褐色沉淀和无色气泡 | X中一定含有Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 物质的类别和其中所含核心元素的化合价研究物质性质的两个重要角度.请根据如图所示,回答下列问题.
物质的类别和其中所含核心元素的化合价研究物质性质的两个重要角度.请根据如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | X | Y | Z | W |
| 相关 信息 | 最外层电子数是 最内层电子数的3倍 | 单质及化合物焰色反应为黄色 | 地壳中含量最多 的金属元素 | 单质为黄色晶体 |
| A. | X与Y形成的化合物只含有离子键 | |
| B. | 4种元素的简单离子半径最大的是W | |
| C. | Y元素构成单质的还原性强于Z元素构成单质 | |
| D. | Y、Z、W的最高价氧化物对应的水化物两两之间均能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
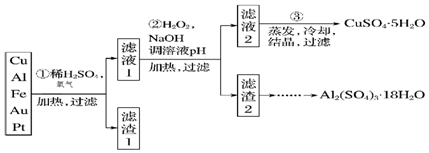
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用洁净的铂丝蘸取某溶液在酒精灯火焰上灼烧,若通过蓝色的钴玻璃观察火焰呈紫色,则原溶液中一定有K+离子,一定没有Na+离子 | |
| B. | 向某溶液中加入AgNO3溶液有白色沉淀产生,再加稀HNO3,沉淀不消失,则原溶液中一定有Cl- | |
| C. | 向某溶液中加入BaCl2溶液有白色沉淀,再加稀HNO3,沉淀不消失,则原溶液中一定有SO42- | |
| D. | 向某溶液中加入稀盐酸若产生能使用澄清石灰水变浑浊的气体,则原溶液中一定有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| c(N2O)/mol•L-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 |
| 反应时间/min | 60 | 70 | 80 | 90 | 100 | |
| c(N2O)/mol•L-1 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
| A. | 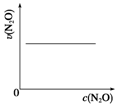 | B. |  | C. | 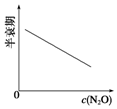 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验内容 | 实验目的 |
| A | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
| B | 室温下,用pH试纸测定浓度为0.1 mol•L-1 NaClO溶液和0.1 mol•L-1 CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| C | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| D | 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O的电子式: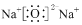 | B. | F-的结构示意图: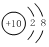 | ||
| C. | 中子数为20的Ar原子:${\;}_{18}^{20}$Al | D. | 苯甲酸的结构简式: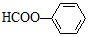 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com