
| A. | 水 | B. | 溴水 | C. | FeCl3溶液 | D. | 银氨溶液 |
分析 己烯含有碳碳双键,可发生加成、氧化反应,四氯化碳和苯都不溶于水,但二者密度不同,丙醛可与溴水发生氧化还原反应,以此解答.
解答 解:A.苯、己烯密度比水小,无法鉴别,故A错误;
B.溴易溶于苯、四氯化碳,苯的密度比水小,有色层在上层,四氯化碳密度比水大,有色层在下层,丙醛与溴水发生氧化还原反应生成丙酸,溶液褪色,己烯与溴发生加成反应而使溴水褪色,溶液分层,四种物质加入溴水中现象各不相同,可鉴别,故B正确;
C.加入FeCl3溶液,不能鉴别苯、己烯,故C错误;
D.银氨溶液不能鉴别苯、己烯,故D错误.
故选B.
点评 本题考查有机物的鉴别,为高频考点,侧重于学生的分析能力的考查,注意把握常见有机物的结构和官能团的性质,注意把握物质的性质的异同,难度不大.


科目:高中化学 来源: 题型:选择题
 和
和 (A、B为不同的原子或原子团)互为同分异构体,称为烯烃的顺反异构.试推断一氯丙烯的同分异构体(不含环状结构)有( )
(A、B为不同的原子或原子团)互为同分异构体,称为烯烃的顺反异构.试推断一氯丙烯的同分异构体(不含环状结构)有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+F2(g)=2HF(g)△H=-Q1 kJ•mol-1 H2(g)+Cl2(g)=2HCl(g)△H=-Q2 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)=2H2O(l)△H=-Q1 kJ•mol-1 2H2(g)+O2(g)=2H2O(g)△H=-Q2 kJ•mol-1 | |
| C. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-Q1 kJ•mol-1 NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-Q2 kJ•mol-1 | |
| D. | S(s)+O2(g)=SO2(g)△H=-Q1 kJ•mol-1 S(g)+O2(g)=SO2(g)△H=-Q2 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5mol(L•min) | B. | v(B)=0.05 mol(L•s) | ||
| C. | v(C)=0.80 mol(L•min) | D. | v(D)=0.85 mol(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
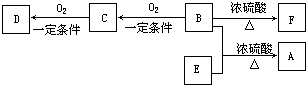
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能/kJ/mol | 436 | 565 | 431 | 368 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,Na+向负极移动 | |
| B. | 放电时,正极上发生的反应为xS+2Na++2e-=Na2Sx | |
| C. | 充电时,阳极上发生的反应为2Na-2e-=2Na+ | |
| D. | 放电时,每有0.4mol电子转移,则有9.2gNa和6.4g硫参加反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
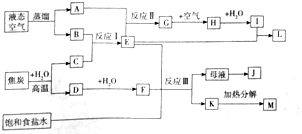
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com