
分析 (1)结合CO2和O2组成可知:n(C)=n(CO2),n(O)=2n(CO2)+2n(O2),结合m=nM以及混合气体的质量为14.0g,其中碳原子与氧原子的物质的量之比是1:8列式计算CO2和O2的物质的量;
(2)根据CO2和O2的物质的量结合V=nVm计算;
(3)根据ρ=$\frac{m}{V}$计算.
解答 解:(1)CO2和O2组成的混合气体中:n(C)=n(CO2),n(O)=2n(CO2)+2n(O2),碳原子与氧原子的物质的量之比是1:8,n(CO2):[2n(CO2)+2n(O2)]=1:8①,根据质量守恒可得n(CO2)×44g/mol+n(O2)×32g/mol=14g②,联①②解得n(CO2)=0.1mol,n(O2)=0.3mol,
答:该混合气体中,CO2和O2的物质的量分别是0.1mol,0.3mol;
(2)该混合气体中,CO2和O2的物质的量分别是0.1mol,0.3mol,总的物质的量为0.1mol+0.3mol=0.4mol,V=nVm=0.4mol×22.4mol/L=8.96L,
答:标准状况下,该混合气体的体积是8.96L;
(3)标准状况下,该混合气体的密度ρ=$\frac{m}{V}$=$\frac{14g}{8.96L}$=1.5625g/L,
答:标准状况下,该混合气体的密度是1.5625g/L.
点评 本题考查物质的量有关计算,关键是根据分子式确定碳原子、氧原子物质的量与混合气体CO2和O2物质的量关系计算CO2和O2各自物质的量,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 欲配制1L 1mol/L的NaCl溶液,可将58.5g NaCl溶于1 L水中 | |
| B. | 用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出 | |
| C. | 实验室制取乙酸乙酯时药品的加入顺序依次为浓硫酸、乙醇、乙酸 | |
| D. | 在制备Fe(OH)2时,把吸有NaOH溶液的胶头滴管插入FeSO4溶液的液面下,挤压胶头滴管,滴滴入NaOH溶液,能较长时间地观察到白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③⑤ | C. | ①③④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
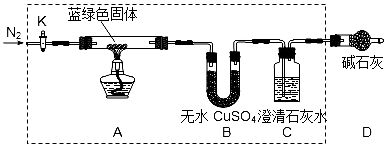
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三者的单质直接与O2反应都能生成两种以上的氧化物 | |
| B. | CO2、NO2、SO2都能与H2O发生化合反应 | |
| C. | CO2、NO2、SO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 三种元素在自然界中既有游离态又有化合态 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 物质 | 熔点 | 沸点 | 溶解度 |
| 乙酰苯胺 | 114.3℃ | 305℃ | 微溶于冷水、易溶于热水 |
| 苯胺 | -6℃ | 184.4℃ | 微溶于水 |
| 醋酸 | 16.6℃ | 118℃ | 易溶于水 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
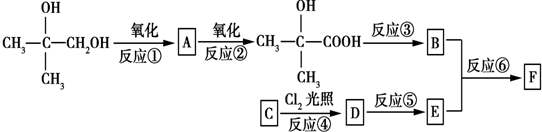
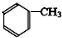 ,反应③的条件是浓硫酸、加热.
,反应③的条件是浓硫酸、加热.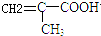 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$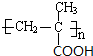 .
.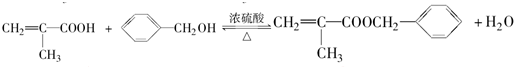 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com