
| A. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔 | |
| B. | 喝补铁剂时,加服维生素C,效果更好,原因是维生素C具有氧化性 | |
| C. | 食用花生油和鸡蛋清都能发生水解反应 | |
| D. | “地沟油”经加工处理后,可用于生产肥皂和生物柴油 |
分析 A.碳酸氢钠受热分解出二氧化碳,使焙制出的糕点疏松多孔;
B.能被人体吸收的铁元素是亚铁离子;
C.食用花生油成分是油脂,鸡蛋清成分是蛋白质;
D,“地沟油”的成分是油脂,用地沟油制备生物柴油作燃料,有利于节约资源、保护环境.
解答 解:A.发酵粉中含有碳酸氢钠,碳酸氢钠受热分解出二氧化碳,使焙制出的糕点疏松多孔,故A正确;
B.能被人体吸收的铁元素是亚铁离子,亚铁离子很容易被氧化为三价铁离子,维生素C具有还原性,能将三价铁还原为亚铁离子,故B错误;
C.食用花生油成分是油脂,鸡蛋清成分是蛋白质,油脂水解生成高级脂肪酸和甘油,蛋白质水解生成氨基酸,故C正确;
D.“地沟油”的成分是油脂,可从地沟油中提炼出油脂作为生物柴油,碱性条件下的水解反应生成肥皂,故D正确;
故选B.
点评 本题主要考查了物质的组成、性质和应用等,主要是碳酸氢钠、亚铁离子、油脂等物质性质的分析判断,题目难度中等,要求学生熟记所学知识,学以致用.


 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol-NH2中含有的电子数为0.7NA | |
| B. | 标准状况下,2.24 L乙醇中含有的C-H数目为0.5NA | |
| C. | 常温常压下,65 g Zn与足量浓H2SO4充分反应,转移电子数一定为2NA | |
| D. | 2.24 L NO与1.12 L O2充分反应所得气体中原子数目一定为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
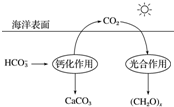
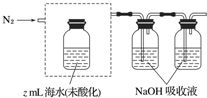
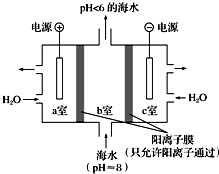
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=10-4mol•L-1的溶液中:NH4+、K+、SO42-、NO3- | |
| B. | 无色溶液中:Na+、Cu2+、Cl-、NO3- | |
| C. | 0.1 mol•L-1AgNO3 溶液:H+、K+、SO42-、I- | |
| D. | 饱和氯水中:Cl-、Na+、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
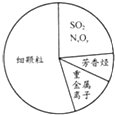
| A. | SO2、NxOy都属于酸性氧化物 | |
| B. | 碳氢化合物和氮氧化合物可引起光化学烟雾 | |
| C. | 重金属离子可导致蛋白质变性 | |
| D. | 汽车尾气的大量排放是造成雾霾天气的人为因素之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1=Q2=Q3 | B. | Q2>Q1>Q3 | C. | Q2>Q3>Q1 | D. | Q2=Q3>Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com