
 ,Al与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑,故答案为:
,Al与NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑,故答案为: ;2Al+2H2O+2OH-=2AlO2-+3H2↑;
;2Al+2H2O+2OH-=2AlO2-+3H2↑;| 160×21.4 |
| 214 |
| 160×21.4 |
| 214 |
| 9g |
| 36g |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、居室内空气中存在的污染物主要来自于装修材料、日用化学品、香烟烟雾以及家用燃料的燃烧产物等 |
| B、燃料不完全燃烧产生的一氧化碳也是一种室内污染物 |
| C、在居室内放置几盒花草就可消除室内空气污染 |
| D、预防装修污染,最重要的是选择经过严格检测的、环保的装修材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、mol/L |
| B、mol/L |
| C、2.5dmol/L |
| D、1.25dmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 所含离子 | NO3- | SO42- | H+ | M |
| 浓度/(mol?L-1) | 2 | 1 | 2 | 1 |
| A、Mg2+ |
| B、Ba2+ |
| C、Na+ |
| D、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
| B、用容量瓶配置溶液,定容时俯视刻度线,所配溶液浓度偏小 |
| C、用湿润的pH试纸测稀碱液的pH,测定值偏小 |
| D、测定中和反应反的应热时,将碱液缓慢倒入酸中,所测温度值偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
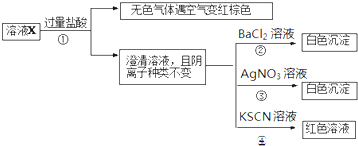
| A、无色气体可能是NO和CO2的混合物 |
| B、由步骤③可以确定原溶液中含有Cl- |
| C、溶液X中所含离子种类共有4种 |
| D、另取l00mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为1.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com