
| A. | 这是一种矿物胶,既不燃烧也不受腐蚀 | |
| B. | 在建筑工业上可以作黏合剂、耐酸水泥掺料 | |
| C. | 木材、织物浸过水玻璃后具有防腐性能且不易燃烧 | |
| D. | 水玻璃的化学性质稳定,在空气中不易变质 |
分析 A、水玻璃是硅酸钠的水溶液,其不燃烧也不受腐蚀;
B、水玻璃是粘性的物质;
C、水玻璃是硅酸钠的水溶液,其不燃烧也不受腐蚀;
D、水玻璃是强碱弱酸盐,性质不稳定.
解答 解:A、水玻璃是硅酸钠的水溶液,是无机物,不燃烧,耐腐性性很强,一般不受腐蚀,故A正确;
B、水玻璃是粘性的物质,所以在建筑工业上,可用做粘合剂、耐酸水泥渗料,故B正确;
C、水玻璃是硅酸钠的水溶液,其不燃烧也不受腐蚀,所以木材、织物浸过水玻璃后,燃烧时,当水分蒸发后不易燃烧,所以具有防腐蚀性能且不易着火,故C正确;
D、水玻璃是强碱弱酸盐,其能与空气中二氧化碳反应生成硅酸,所以性质不稳定,故D错误;
故选D.
点评 本题考查了硅酸钠的性质及用途,题目难度难度不大,熟练掌握硅酸钠的性质是解决本题的关键,注意基础知识的积累.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
| A. | CO的还原性强于Pd | |
| B. | 反应中PdCl2被氧化 | |
| C. | 若反应生成22.4 L CO2,则转移电子的物质的量一定为2 mol | |
| D. | CO气体只有在高温下才能表现出还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2AlCl3(熔融) $\frac{\underline{\;电解\;}}{冰晶}$ 4Al+3Cl2↑ | |
| B. | Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 | |
| C. | Fe+CuSO4═FeSO4+Cu | |
| D. | 2KCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2K+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2+Cl2→CH2ClCH2Cl | B. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | ||
| C. | 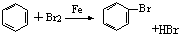 | D. | 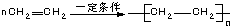 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消除制硝酸工业尾气中的氮氧化物的污染:NO+NO2+2NaOH═2NaNO2+H2O | |
| B. | 消除硫酸厂尾气中的SO2:SO2+2NH3•H2O═(NH4)2SO3+H2O | |
| C. | 用反应: 制备环氧乙烷 制备环氧乙烷 | |
| D. | 制CuSO4:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
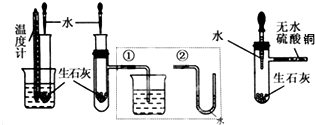
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
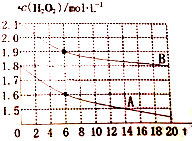 现有如下溶液:①1.0mL0.10mol•L-1双氧水 ②1.0mL0.20mol•L-1双氧水 ③3.0mL0.10mol•L-1KMnO4溶液 ④3.0mL0.010mol•L-1KMnO4溶液.所有实验均需加入1.0mL稀硫酸(足量),依据褪色时间长短判定反应速率快慢:
现有如下溶液:①1.0mL0.10mol•L-1双氧水 ②1.0mL0.20mol•L-1双氧水 ③3.0mL0.10mol•L-1KMnO4溶液 ④3.0mL0.010mol•L-1KMnO4溶液.所有实验均需加入1.0mL稀硫酸(足量),依据褪色时间长短判定反应速率快慢:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com