
分析 (1)反应的平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,固体和纯液体不写入表达式,平衡常数只随温度变化;反应是吸热反应,升温促进平衡正向进行,平衡常数增大;
(2)反应是气体体积不变的吸热反应,反应达到平衡状态,正逆反应速率相同时,各组分含量保持不变,变量不变说明反应达到平衡状态;
(3)根据方程式计算反应的氢气的物质的量,再求出反应速率;
(4)二氧化硫水溶液呈酸性,C1O-在酸性条件下具有强氧化性,可与二氧化硫发生氧化还原反应,以此解答该题;
(5)亚硫酸钠是强碱弱酸盐,亚硫酸钠水解而使溶液呈碱性,滴入酚酞,溶液变红;再滴入过量的BaCl2溶液,亚硫酸根离子和钡离子反应生成亚硫酸钡沉淀,由于SO32-浓度减小,水解平衡左移,OH-浓度减小,溶液褪色,据此即可解答.
解答 解:(1)Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g),反应的平衡常数表达式K=$\frac{[{H}_{2}O]^{4}}{[{H}_{2}]^{4}}$,影响化学平衡的因素有温度、压强、浓度等,改变一个条件平衡发生移动,但平衡常数只随温度变化,不随压强、浓度的改变,所以若只改变一个影响因素,当平衡移动时,K值不一定变化,反应是吸热反应,当K值变大时,说明是温度影响,平衡正向进行,说明是升温平衡正向进行,正逆反应速率都增大,
故答案为:$\frac{[{H}_{2}O]^{4}}{[{H}_{2}]^{4}}$;不一定;增大;
(2)Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g),反应是气体体积不变的吸热反应,
a.反应前后气体体积不变,反应过程中容器内压强始终保持不变,反应达到平衡状态,压强不变,故a正确;
b.反应达到平衡状态,物质的量不变,氢气和水蒸汽的物质的量之比保持不变,故B正确;
c.固体不影响化学平衡,加入少量Fe3O4固体和水蒸气反应,平衡正向移动,故c错误;
d.固体不影响化学平衡,移除部分Na2S固体,平衡不发生移动,故d错误;
故答案为:cd;
(3)设反应消耗的氢气为nmol,
Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g)△m
4mol 64 g
n (2.84-2.264)g
解得n=0.036mol,则该时间范围内的平均反应速率v(H2)=$\frac{\frac{0.036mol}{2L}}{10min}$═0.0018mol/(L.min),
故答案为:0.0018 mol/(L•min);
(4)往Ba(C1O)2溶液中通入足量SO2气体发生Ba(C1O)2+2SO2+2H2O=BaSO4↓+H2SO4+2HCl,则反应后溶液的溶质为H2SO4、HCl,
故答案为:H2SO4,HCl;
(5)亚硫酸钠是强碱弱酸盐,亚硫酸钠水解而使溶液呈碱性,SO32-+H2O?HSO3-+OH-,滴入酚酞,溶液变红;再滴入过量的BaCl2溶液,亚硫酸根离子和钡离子反应生成亚硫酸钡沉淀,Ba2++SO32-═BaSO3↓(白色),由于SO32-浓度减小,水解平衡左移,OH-浓度减小,溶液褪色,
故答案为:白色沉淀生成,溶液红色褪去;亚硫酸钠溶液水解成碱性,滴入酚酞成红色.SO32-+H2O?HSO3-+OH-,加入氯化钡后,Ba2++SO32-→BaSO3↓,降低了SO32-的浓度,使得水解平衡往左移动,导致溶液中OH-浓度降低,因此溶液红色褪去.
点评 本题考查了反应速率的计算、化学平衡常数计算、平衡标志的判断方法、影响平衡的因素等,物质性质和盐类水解原理是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LN2和O2的混合气体中所含分子总数为6.02×1023 | |
| B. | 常温常压下,等质量的O2和O3中所含的氧原子数均为6.02×1023 | |
| C. | 2L 0.5mol/LNa2SO4溶液中所含离子总数为6.02×1023 | |
| D. | H2O2催化分解生成0.5molO2时转移电子数目为1.204×1024 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在通常状况下,A为固态单质.根据下图转化关系,回答:
在通常状况下,A为固态单质.根据下图转化关系,回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浓H2SO4刻蚀工艺玻璃上的纹饰 | |
| B. | 高纯度的硅单质广泛用于制作光导纤维 | |
| C. | 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 | |
| D. | 制饭勺、饭盒、高压锅等的不锈钢是合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
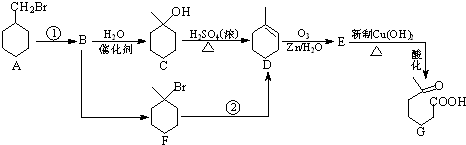

 +NaOH+2Cu(OH)2$\stackrel{△}{→}$
+NaOH+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+3H2O;
+Cu2O↓+3H2O; 物质D与呋喃(
物质D与呋喃( )也可以发生“Diels-Alder反应”,该化学反应方程式为
)也可以发生“Diels-Alder反应”,该化学反应方程式为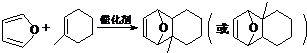 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
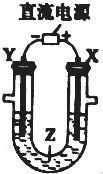
| A. | 氯碱工业中,X电极上反应式是4OH--4e-═2H2O+O2↑ | |
| B. | 电解精炼铜时,Z溶液中的Cu2+浓度变小 | |
| C. | 制取金属镁时,Z是熔融的氧化镁 | |
| D. | 在铁片上镀铜时,Y是纯铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、AlO2-、Cl-、SO42- | B. | H+、Ba2+、Cl-、NO3- | ||
| C. | Ca2+、Fe2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、SO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com