
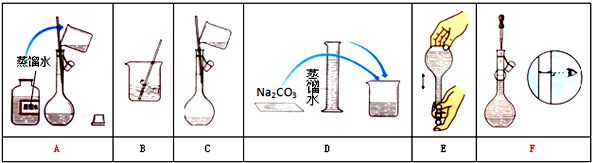
分析 (1)根据n=cv计算溶质Na2CO3的物质的量,利用Na2CO3•10H2O的物质的量等于Na2CO3的物质的量,根据m=nM计算Na2CO3•10H2O的质量;
(2)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,据此分析正确的操作顺序;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差判断;
(4)硫酸过量,碳酸钠完全反应生成二氧化碳,根据n=cV计算碳酸钠的物质的量,根据碳原子守恒计算二氧化碳的物质的量,再根据V=nVm计算二氧化碳的体积;根据c=$\frac{n}{V}$计算反应后钠离子的浓度.
解答 解:(1)因配制溶液的体积为240ml,而容量瓶的规格没有240ml,只能选用250ml,Na2CO3的物质的量n=cV=0.25L×0.2mol•L-1=0.05mol,Na2CO3•10H2O的物质的量等于Na2CO3的物质的量,所以Na2CO3•10H2O的质量0.05mol×286g/mol=14.3g,
故答案为:14.3;
(2)配制一定物质的量浓度一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,所以正确的顺序为:BCAFED;
故答案为:BCAFED;
(3)所选用的溶质已经变质,部分已失去了结晶水,导致溶质的物质的偏大,溶液浓度偏高,故选;
B.转移前,容量瓶中含有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故不选;
C.将未冷却的溶液沿玻璃棒注入容量瓶中,冷却后溶液体积偏小,溶液浓度偏高,故选;
D.定容时,仰视刻度线导致溶液体积偏大,溶液浓度偏低,故不选;
E.称量时误操作为“左码右物”,依据左盘质量=右盘质量=游码质量,实际称取固体质量=14g-0.3g=13.7g,称取的溶质的质量偏小,溶质的物质的量偏小,溶液浓度偏低,故不选;
F.定容后使溶液混匀静止,发现凹液面低于刻度线,立即滴蒸馏水至刻度线,导致溶液体积偏大,溶液浓度偏低,故不选;
故选:AC;
(4)125mL0.2mol/LNa2CO3溶液中碳酸钠的物质的量=0.125L×0.2mol/L=0.025mol,125mL 0.3mol•L-1 的硫酸溶液中硫酸的物质的量=0.125L×0.3mol/L=0.0375mol,故硫酸过量,碳酸钠完全反应生成二氧化碳,由碳原子守恒可知二氧化碳的物质的量为0.025mol,体积为0.025mol×22.4L/mol=0.56L,即560mL;
反应后溶液中钠离子物质的量不变,为0.025mol×2=0.05mol,故钠离子的物质的量浓度=$\frac{0.05mol}{0.25L}$=0.2mol/L,
故答案为:560; 0.2 mol/L.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和步骤是解题关键,注意误差分析的方法,题目难度不大.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
某市对大气进行监测,发现首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。将PM2.5样本用蒸馏水处理制成溶液,该溶液中所含水溶性无机离子的浓度如下表:
离子 | K+ | Na+ | NH4+ | H + | SO42- | NO3- | Cl- |
浓度/mol·L-1 | 4×10-6 | 6×10-6[ | 2×10-5 | x | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断H+ 的浓度为 mol·L-1
A.1×10-5 mol·L-1 B.3×10-5 mol·L-1
C.6×10-5 mol·L-1 D.1×10-4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
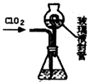 二氧化氯(C1O2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水.实验室可用Fa-14Cl、盐酸、NaCl02(亚氯酸钠)为原料制备C1O2的流程如下:
二氧化氯(C1O2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水.实验室可用Fa-14Cl、盐酸、NaCl02(亚氯酸钠)为原料制备C1O2的流程如下: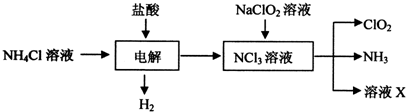
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com