
��1����ѧ����������������������ء��밴Ҫ��ش��������⣺
�������ҹ��Ŵ��ļ���Ӧ���У��乤��ԭ�����漰��ѧ��Ӧ���� ������ĸ��
A����ҩʹ�� | B����ʳ��� | C��ת������ | D.����ұ�� |
|
|
|
|
��������Ʒ����Ч�ɷּ���;��Ӧ������� ������ĸ��
A | B | C | D | |
��Ʒ |
| |
|
|
��Ч�ɷ� | NaCl | NaOH | NaHCO3 | Ca(ClO)2 |
��; | ����ζƷ | ������θ���Ŀ���ҩ | �����ͷ� | �������� |
�۹�ҵ�ϳ���������ʯ���鷴Ӧ����Ư�ۣ���ԭ����_________________���û�ѧ����ʽ��ʾ����
���������У���������Ũ��ˮ�����������ܵ��Ƿ�©������������ܵ�ij��©������Ũ��ˮ���ʱ�ͻ�������̵�������֪��ʱ���������е������ɵ��û���Ӧ�����ʱ������Ӧ�Ļ�ѧ����ʽΪ____________��
��2����ѧ�����о���ѧ����ʱ�����������ʽ��з��࣬�Ա��ͬ�����ʵ���ɺ����ܽ���������о������ʷ��༰ת��˼��ᴩ������ѧ��ѧϰ��ʼ�ա�
��������ʮ�����ʣ�
A������ B��O2 C��NaHSO4 D����ˮ E��CuSO4��5H2O F��NaOH
G��CO2 H��Fe2O3 I�����ʯ J��H2SO4
�������ڻ������� �����ڵ��ʵ��� �������ε��� ��������ĸ��
��������������Ӧ��
A��Cl2��H2O = HCl��HClO
B��Zn + H2SO4 = ZnSO4 + H2��
C��2Cu2O + Cu2S  6Cu+SO2��
6Cu+SO2��
D��Cl2��2KI = 2KCl��I2
E��H2 + Cl2  2HCl
2HCl
F��2KClO3 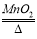 2KCl+3O2��
2KCl+3O2��
���������û���Ӧ���� �������ڷֽⷴӦ������������ԭ��Ӧ���� ������ĸ����
��K2FeO4��һ����Ҫ�ľ�ˮ�����������з����Ƶã�
2Fe(OH)3+3Cl2+10KOH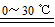 2K2FeO4+6KCl+8H2O
2K2FeO4+6KCl+8H2O
�ڸ÷�Ӧ�У���ԭ���� ������Ӧ����1mol K2FeO4����ʱ��ת�Ƶ��ӵ���ĿΪ ��
��3�����ʵ����ǻ�ѧ����ĺ��ġ��밴Ҫ�����������գ�
����֪3.01��1023��X������ӵ�����Ϊ8g����X�����Ħ�������� ��
�ں�0.4 mol Al3����Al2O3�������� ��
��ij���±ʯ��KCl��MgCl2��6H2O���к�5.3250 g Cl������ù�±ʯ�����ʵ���Ϊ ��
�ܱ�״���£�224mL�İ����к��е���ԭ����Ϊ ��
 �ظ���ʦ�㲦ϵ�д�
�ظ���ʦ�㲦ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�߶���ѧ�����У��ģ���ѧ�Ծ��������棩 ���ͣ�ѡ����
���й���ҩ���ʹ��˵����ȷ����
A����Ȼҩ�����β�������ҩ���ж�������
B��ʹ����ù��ʱ��ֱ�Ӿ���ע����Բ��ý���Ƥ����������
C�����ڴ���ʹ�ð�˾ƥ�ֿ�Ԥ��������û�и�����
D������ҩ����ռ��������˶����Ե�ҩ���Լ���ҩ�ԣ����õ�ҽԺ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�������и�����ѧ��9���¿����ۻ�ѧ�Ծ��������棩 ���ͣ������
��1��������ѧ��ѧ��������:�ơ����������ơ��������ơ���������������.����������һ���������ܷ���H2O����������ԭ��Ӧ���еķ�������:

��ش���������:
�ٵ���ɫ�������� (�ӡ���~����ѡ��)�飬���������ʰ��� (��д����ʽ).
�ڼ����е�������ʹ��ˮ��ɫ,�䷴Ӧ�����ӷ���ʽΪ .
�۱����е�ijһ�������ڸ���ʱ������ˮ������Ӧ,�仯ѧ����ʽΪ .��һ����Ͷ��������Ca(HCO3)2��Һ�з�Ӧ��������ͳ���,д�����ɳ��������ӷ���ʽΪ .
��2�����ڽ������ӵ�ij�ֺ�������ҩƤ�ɴ���ʯ��ˮ�ࡢ���������ƶ��ɡ�
��Al��NaOH��Һ��Ӧ�����ӷ���ʽΪ___________________��
�ں��ӹ����У�ҩƤ�ڸ����²�����������ʹ�����������������壬��������__________��
�۾������������36.0 g(����Fe2O3��Al2O3��SiO2)����������ϡ���ᣬ����õ�11.0 g���壻��Һ�м������NaOH��Һ������õ�21.4 g���壻���������Al2O3����������Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�����ظ߶���ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ʼ�ķ�Ӧ������ȥ��Ӧ����
A����ϩ����ͨ��������Ȼ�̼��Һ
B������Ũ����ͱ���Ũ��������������ȡ������
C��������������������ص�ˮ��Һ
D��������������������صĴ���Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�����ظ߶���ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�ڹ��������£���1mol�����1mol������ϳ�ַ�Ӧ��,�õ��IJ���Ϊ
A��CH3Cl��HCl B��HCl��CCl4
C��CH3Cl��CH2Cl2 D��CH3Cl��CH2Cl2��CHCl3��CCl4��HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�����ظ�һ��ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ijԪ�ض��������ӵĺ�����18�����ӣ�������Ϊ34����Ԫ�ص�ԭ�Ӻ��е�������Ϊ
A��16 B��18 C��20 D��22
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�����ظ�һ��ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ�鷽���������ȷ����

A��ת����Һ B��������ˮ C������ˮ�;ƾ� D��ϡ��Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�߶���ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
������������Ҫ������������ԭ��������ˮ��Һ�ֳ�Ϊ˫��ˮ��������������ɱ����Ư�ȡ�ij��ѧ��ȤС��ȡһ�����Ĺ���������Һ��ȷ�ⶨ�˹��������Ũ�ȣ� ����д���пհף�
��1����10.00 mL����������Һ����250mL (����������)�У���ˮϡ�����̶ȣ�ҡ�ȡ���ȡϡ�ͺ�Ĺ���������Һ25.00mL����ƿ�У�����ϡ�����ữ��������ˮϡ�ͣ�������������
��2���ø�����ر���Һ�ζ������������䷴Ӧ�����ӷ���ʽ���£��뽫������ʵĻ�ѧ�������ֱ��������к��ߺ������ڡ�
MnO4�� + H2O2 + H+ = Mn2+ + O2 + H2O
��3��KMnO4��Һװ�� �ζ��ܣ��ζ������յ��������
��4���ظ��ζ����Σ�ƽ������c mol/L KMnO4����ҺV mL����ԭ����������Һ�й��������Ũ��Ϊ
��5����ʢװ������ر���Һ�ĵζ���������ˮϴ��û���ñ�Һ��ϴ����ⶨ��� (�ƫ�ߡ���ƫ�͡����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ӱ�ʡ�߶���ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ������
�����£���25mL 0.1mol/L MOH��Һ����μ���0.2mol/L HA��Һ��������ͼ��ʾ������仯���Բ��ƣ����ش��������⣺
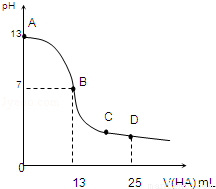
��1��д��MOH�ĵ��뷽��ʽ��____________________
��2��MOH��HAǡ����ȫ��Ӧʱ�������Һ����ˮ�������c��H+��__________0.2mol/L HA��Һ����ˮ�������c��H+�����������������=������
��3���ֱ�д��B��C���㣬�����Һ�и�����Ũ�ȵĴ�С��ϵB��______________��C��___________��
��4����D���û����Һ��pH=3���� c��HA��+c��H+��=_____________
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com