
【题目】PVAc是一种具有热塑性的树脂,可合成重要高分子材料M,合成路线如下:
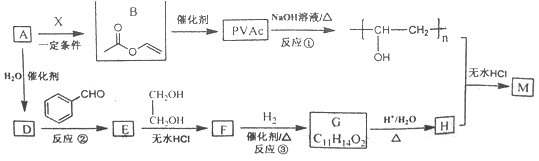
己知:R、R'、R"为H原子或烃基。
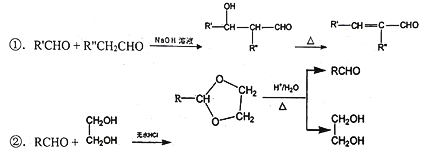
③羟基连在碳碳双键或碳碳三键上不稳定。
(1)已知标准状况下,3.36L气态烃A的质量是3.9g, A—B为加成反应,则X的结构简式为________;B中官能团的名称是_______。
(2)E能使溴的四氯化碳溶液褪色,反应②的反应试剂和条件是____,在E→F→G→H的转化过程中,乙二醇的作用是______。
(3)反应①的化学方程式为_______。
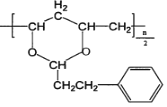
(4)己知M的链节中除苯环外,还含有六元环状结构,则M的结构简式为____________。
(5)E的同分异构体中含有苯环和甲基,且甲基不与苯环直接相连的同分异构体有_____种。
(6)以甲醇、本乙醛以及上述合成路线中的必要有机试剂为原料合成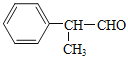 (其他无机试剂任选),请写出合成路线_______。
(其他无机试剂任选),请写出合成路线_______。
【答案】CH3COOH 酯基、碳碳双键 稀NaOH溶液、加热 保护醛基不被H2还原 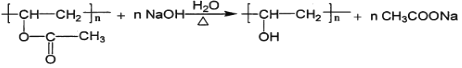
 8;
8; 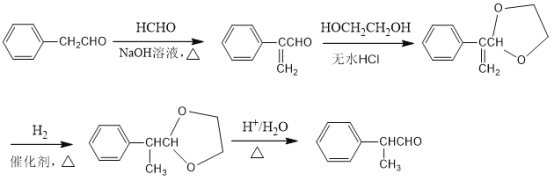
【解析】
标准状况下,3.36L气态烃A的质量是3.9g,则相对摩尔质量为![]() =26g/mol,应为HC≡CH,A与X反应生成B,由B的结构简式可知X为CH3COOH,X发生加聚反应生成PVAc,结构简式为
=26g/mol,应为HC≡CH,A与X反应生成B,由B的结构简式可知X为CH3COOH,X发生加聚反应生成PVAc,结构简式为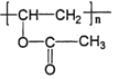 ,由转化关系可知D为CH3CHO,由信息Ⅰ可知E为
,由转化关系可知D为CH3CHO,由信息Ⅰ可知E为![]() ,由信息Ⅱ可知F为
,由信息Ⅱ可知F为![]() ,结合G的分子式可知G应为
,结合G的分子式可知G应为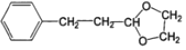 ,H为
,H为![]() ,在E→F→G→H的转化过程中,乙二醇可保护醛基不被H2还原,M为
,在E→F→G→H的转化过程中,乙二醇可保护醛基不被H2还原,M为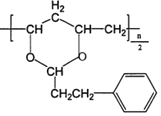 ;
;
在以甲醛、苯乙醛( 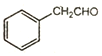 )及上述合成路线中的必要有机试剂为原料合成
)及上述合成路线中的必要有机试剂为原料合成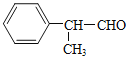 时,先发生类似信息I中甲醛、苯乙醛的反应,再与乙二醇发生类似E→F的反应,再碳碳双键发生与氢气的加成反应,最后发生信息II中后面一步的反应即可。
时,先发生类似信息I中甲醛、苯乙醛的反应,再与乙二醇发生类似E→F的反应,再碳碳双键发生与氢气的加成反应,最后发生信息II中后面一步的反应即可。
(1)由上述分析可知X为CH3COOH,根据B的结构简式可知:B中官能团的名称是酯基、碳碳双键;
(2)E为![]() ,由D和苯甲醛在稀NaOH溶液和加热条件下反应生成,反应②的反应试剂和条件是稀NaOH溶液、加热,在E→F→G→H的转化过程中,乙二醇的作用是保护醛基不被H2还原;
,由D和苯甲醛在稀NaOH溶液和加热条件下反应生成,反应②的反应试剂和条件是稀NaOH溶液、加热,在E→F→G→H的转化过程中,乙二醇的作用是保护醛基不被H2还原;
(3)反应①的化学方程式为 ;
;
(4)M的链节中除苯环外,还含有六元环状结构,则M的结构简式为 ;
;
(5)E为![]() ,E的同分异构体中含有苯环和甲基,且甲基不与苯环直接相连,则应有2个取代基,分别为—OH、—C≡C-CH3,存在邻、间、对位置,共3种,若含醚键且只有一个取代基时有2种,含醚键有甲氧基、乙炔基存在邻间对3种,总共8种同分异构体;
,E的同分异构体中含有苯环和甲基,且甲基不与苯环直接相连,则应有2个取代基,分别为—OH、—C≡C-CH3,存在邻、间、对位置,共3种,若含醚键且只有一个取代基时有2种,含醚键有甲氧基、乙炔基存在邻间对3种,总共8种同分异构体;
(6)以甲醛、苯乙醛( )以及上述合成路线中的必要有机试剂为原料合成
)以及上述合成路线中的必要有机试剂为原料合成 ,先发生类似信息I中甲醛、苯乙醛的反应,再与乙二醇发生类似E→F的反应,再碳碳双键发生与氢气的加成反应,最后发生信息II中后面一步的反应,合成流程为:
,先发生类似信息I中甲醛、苯乙醛的反应,再与乙二醇发生类似E→F的反应,再碳碳双键发生与氢气的加成反应,最后发生信息II中后面一步的反应,合成流程为: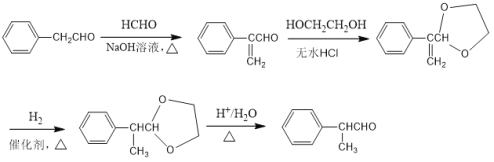 。
。


科目:高中化学 来源: 题型:
【题目】醋硝香豆素是一种洽疗心脑血管疾病的药物,能阻碍血栓扩展。醋硝香豆素可以通过以下方法合成(部分反应条件已省略)。
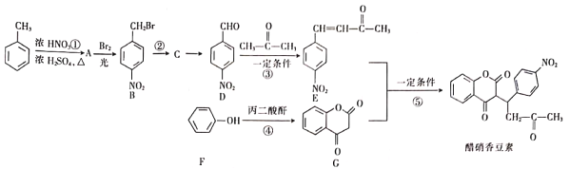
请回答下列问题:
(1)A的名称是___________;醋硝香豆素中所含官能团的名称为___________。
(2)反应①的反应类型是___________;反应⑤的反应类型为___________。
(3)C的结构简式为___________;反应④的化学方程式为______________________。
(4)关于E物质下列说法正确的是___________(填字母)
a.可以用酸性高锰酸钾溶液鉴别D和E
b.在核磁共振氢谱中有五组吸收峰
c存在顺反异构
d可以发生加成反应、聚合反应、氧化反应和消去反应
(5)分子结构中只含有一个环,且同时符合下列条件的G的同分异构体共有___________种
①可与氯化铁溶液发生显色反应;②可与碳酸氢钠溶液反应生成二氧化碳气体。
其中,苯环上的一氯代物只有两种的结构简式为___________。区分上述G的各种同分异构体可选用的仪器是___________(填字母)
a.元素分析仪 b.红外光谱仪 c.核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在任何温度下均能自发进行的是
A. 2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B. Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C. HgO(s)===Hg(l)+O2(g) ΔH=+91 kJ·mol-1
D. H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2通过下列工艺流程可制化工业原料H2SO4和清洁能源H2。
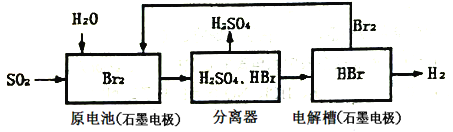
下列说法中错误的是
A. 电解槽中不能用铁电极代替石墨作为阳极
B. 原电池中负极的电极反应为:SO2+2H2O-2e-=SO42-+4H+
C. 该工艺流程用总反应的化学方程式表示为:SO2+Br2+2H2O=2HBr+H2SO4
D. 该生产工艺的优点Br2被循环利用,原电池产生的电能可充分利用,还能获得清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列正确的是( )
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列正确的是( )

A. 0-20 s内平均反应速率v(N2O5)="0.1" mol·L-1·s-1
B. 10 s时,正、逆反应速率相等,达到平衡
C. 20 s时,正反应速率大于逆反应速率
D. 曲线a表示NO2的物质的量随反应时间的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(23V)被称为“现代工业味精”,可添加在钢铁中,并以钛一铝-钒合金的形式用于航天领域;钒的化合物被广泛用作催化剂、燃料及电池等。我国钒钛磁铁矿储量较大,是世界上产钒大国。请完成下列问题:
(1)钒的基态原子的价电子排布图为___________。
(2)钒的某种氧化物的晶胞结构如下图1所示,则该氧化物的化学式为___________,其熔沸点比下图3(为邻苯二甲酸酐的结构)物质的熔沸点要___________(填“高”“低”或“差不多”)。
(3)V2O5是一种常见的催化剂,在合成硫酸、硝酸、邻苯三甲酸酐、乙烯、丙烯中,均使用五氧化二钒作催化剂。

①五氧化二钒的结构简式如上图2所示,则该结构中含有___________个π键。
②在丙醛( CH3CH2CHO)分子中碳原子的杂化方式分别为___________。
③C、N、O、Ne四元素,其第一电离能从大到小的顺序依次为______________________。
④V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。列举与VO43-空间构型相同的一种阴离子:___________(填离子符号)。
(4)已知单质钒的晶体采用体心立方堆积,晶胞如上图4所示,假设钒原子直径为d×10-7cm,钒的相对原子质量为M,则晶体密度的表达式为___________g·cm-3。(设阿伏加德罗常数为NA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com