
| 电化学应用 | 相关解释或说法 | |
| A | 以稀H2SO4为电解质的Cu-Zn原电池 | Cu为正极,正极上发生还原反应 |
| B | 电解CuCl2溶液 | 电子经过负极→阴极$\stackrel{通过电解液}{→}$阳极→正极 |
| C | 弱酸性环境下钢铁腐蚀 | 负极产生H2,正极处吸收O2 |
| D | 将铜闸门与外加电源负极相连 | 牺牲阳极的阴极保护法,可防止钢闸门腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.原电池中,正极上得电子发生还原反应;
B.电解时,电子不进入电解质溶液;
C.弱酸性条件下钢铁发生吸氧腐蚀;
D.金属的腐蚀与防护中如果有外接电源,此方法为外加电源的阴极保护法.
解答 解:A.该装置构成原电池,锌作负极,铜作正极,正极上氢离子得电子生成氢气,发生还原反应,故A正确;
B.无论原电池还是电解池,电子都不进入电解质溶液,电解质溶液中阴阳离子的定向移动而构成闭合回路,故B错误;
C.酸性条件下,钢铁发生析氢腐蚀,弱酸性条件下,钢铁发生吸氧腐蚀,所以弱酸性环境下钢铁腐蚀,负极处产生亚铁离子,正极处吸收O2,故C错误;
D.将钢闸门与外加电源负极相连,阴极上电解质溶液中阳离子得电子发生还原反应,此方法为外加电源的阴极保护法,可防止钢闸门腐蚀,故D错误;
故选A.
点评 本题考查原电池原理和电解池原理,易错选项是B,注意电子不能进入电解质溶液,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 科学仪器的使用利于我们认识物质的微观世界,现在人们借助扫描隧道显微镜,应用STM技术可以“看”到越来越细微的结构,并实现对原子或分子的操纵 | |
| B. | 视频《穹顶之下》再次引起公众对“PM2.5”的关注.“PM2.5”是指大气中直径小于或等于2.5×10-6m的细小颗粒物,这些颗粒扩散在空气中形成胶体 | |
| C. | 臭氧是一种有鱼腥味、氧化性极强的淡蓝色气体,可用作自来水的消毒剂 | |
| D. | 我国油品从国 IV 汽油升级到国 V 汽油,有助于减少酸雨、雾霾,提高空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
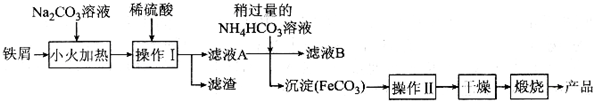
 淮南是我国重要的煤炭生产基地,通过煤的气化和液化,能使煤炭得以更广泛的应用.
淮南是我国重要的煤炭生产基地,通过煤的气化和液化,能使煤炭得以更广泛的应用.| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 1.20 | 1.04 | 0.90 | 0.70 | 0.70 |
| n(CO)/mol | 0.80 | 0.64 | 0.50 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| l0 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.017 | 0.034 |
| 50 | 0.032 | 0.017 | 0.034 |
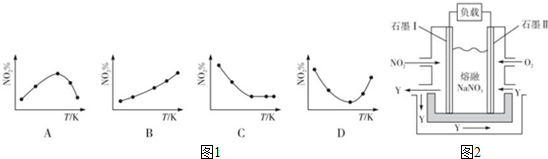
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | HCN | 5×10-10 |
| H2CO3 | Ka1=4.2×10-7 | HClO | 3×10-8 |
| Ka2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com