
【题目】磷酸二氢钾(KH2PO4)在工业、农业、医药及食品等行业均有广泛的应用。利用氟磷灰石(化学式为Ca5P3FO12)制备磷酸二氢钾的工艺流程如图所示(部分流程步骤已省略):

其中,萃取是因为KCl和H3PO4产生的HCl易溶于有机萃取剂。请回答下列问题:
(1)氟磷灰石(Ca5P3FO12)中磷元素的化合价是____。
(2)用化学反应原理解释KCl和H3PO4生成KH2PO4的原因: ________。
(3)沸腾槽不能采用陶瓷材质的原因是_______(用化学方程式表示)。
(4)在得到N的流程中“……”的操作步骤是______、洗涤、干燥。
(5)在萃取过程中,影响萃取率的因素复杂,下图是投料比![]() 对萃取率的影响曲线,在实际操作中,应选择投料比
对萃取率的影响曲线,在实际操作中,应选择投料比![]() 的范围是___(填序号)。
的范围是___(填序号)。

A.0.2~0.4 B.0.4~0.6 C.0.6~0.8 D.0.8~1.0 E.1.0~1.2
(6)电解法制备KH2PO4是用石墨作电极,将电解槽分为a区和b区,中间用阳离子交换膜隔离,a区为3 mol·L-1 H3PO4,b区为3 mol·L-1 KCl。阳极区为____(填“a”或“b”)区,其电极反应式是________。
【答案】+5 该反应是KCl+H3PO4![]() KH2PO4+HCl,加入有机萃取剂后,HCl被萃取到有机层中,水溶液中c(HCl)减小,使得平衡向生成KH2PO4的方向移动 4HF+SiO2=2H2O+SiF4 (减压)蒸发浓缩、冷却结晶、过滤 E b 2Cl--2e-=Cl2↑
KH2PO4+HCl,加入有机萃取剂后,HCl被萃取到有机层中,水溶液中c(HCl)减小,使得平衡向生成KH2PO4的方向移动 4HF+SiO2=2H2O+SiF4 (减压)蒸发浓缩、冷却结晶、过滤 E b 2Cl--2e-=Cl2↑
【解析】
(1)氟磷灰石(Ca5P3FO12)中Ca、F、O的化合价分别为+2、-1、-2,依据化合物中各元素化合价为0的原则,磷元素的化合价是+5。
(2)依据复分解反应发生的条件,KCl和H3PO4不能发生反应,现在反应能发生,说明生成物中至少有一种物质的浓度减少,据反应的实际情况,只能是萃取剂所起的作用。从而得出生成KH2PO4的原因:该反应是KCl+H3PO4![]() KH2PO4+HCl,加入有机萃取剂后,HCl被萃取到有机层中,水溶液中c(HCl)减小,使得平衡向生成KH2PO4的方向移动。
KH2PO4+HCl,加入有机萃取剂后,HCl被萃取到有机层中,水溶液中c(HCl)减小,使得平衡向生成KH2PO4的方向移动。
(3)沸腾槽不能采用陶瓷材质的原因是4HF+SiO2=2H2O+SiF4。
(4)在得到N的流程中“……”的操作步骤,也就是从溶液中获得溶质的方法,(减压)蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(5)在萃取过程中,影响萃取率的因素复杂,在实际操作中,选择投料比时,以转化率高为佳,故![]() 的范围是1.0~1.2。答案为:E
的范围是1.0~1.2。答案为:E
(6)电解法制备KH2PO4是用石墨作电极,将电解槽分为a区和b区,中间用阳离子交换膜隔离,a区为3 mol·L-1 H3PO4,b区为3 mol·L-1 KCl。因为H3PO4应得电子,生成H2和H2PO4-,所以H3PO4应在阴极区,从而得出KCl在阳极区。阳极区为b区。其电极反应式是2Cl--2e-=Cl2↑。


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:
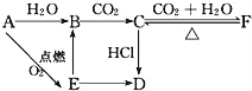
(1)写出A、B、C、D、E、F的化学式:
A.___,B.___,C.___,D.___,E.___,F.___。
(2)写出有关反应的化学方程式(是离子反应的直接写离子方程式)。
A→E:___,
E→B:___,
F→C:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海洋资源获得的部分物质如下图所示,有关说法正确的是

A. 在化学反应中,![]() H2O可转变为D2O
H2O可转变为D2O
B. “加碘食盐”生产中碘添加剂为单质I2
C. 实验室用带玻璃塞的棕色瓶贮存液Br2
D. 电解饱和MgCl2溶液时在阴极得到Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法不正确的是

A.过程I中太阳能转化为化学能
B.过程II中化学能转化为电能
C.2molH2与1molO2的能量之和小于2mol H2O的能量
D.H2O的分解反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将某浅黄色固体(由X、Y两种元素组成)和焦炭混合,加热,发生反应,其装置如图所示。先通入氮气,再点燃I、Ⅲ中的酒精灯,实验中观察到I中生成银白色金属,Ⅱ、Ⅳ中溶液变浑浊、Ⅲ中黑色粉末变成红色。下列叙述不正确的是
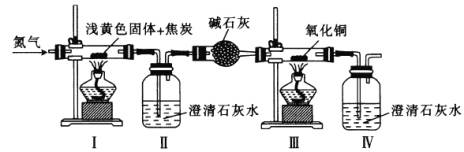
A.X可能是钠元素,Y一定是氧元素
B.浅黄色固体与焦炭在高温下反应生成CO2和CO
C.先通入氮气的目的是排尽装置中的空气
D.用燃烧法处理Ⅳ排放的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以MnO2、KClO3、CaCO3及盐酸等为原料制取KMnO4的步骤如下:
Ⅰ.MnO2的氧化![]()
Ⅱ.CO2的制取![]()
Ⅲ.K2MnO4的歧化及过滤和结晶等
回答下列问题:
(1)实验前称取2.5g KClO3、5.2g KOH、3.0g MnO2并充分混合。氯酸钾需过量,其原因是____________________________;熔融时除了需要酒精灯、三脚架、坩埚钳、细铁棒及铁坩埚外,还需要的硅酸盐质仪器有___________________
(2)为了体现“绿色化学”理念,某同学设计了如图所示的“K2MnO4歧化”实验装置。在大试管中装入块状CaCO3,并关闭K2,向长颈漏斗中加入一定量6mol·L-1的盐酸;向三口烧瓶中加入K2MnO4溶液。

①实验时,不用装置(a)(启普发生器)制取CO2而用装置(b)制取,这是因为______。

②为了充分利用CO2,实验开始时需关闭____________(填“K1”“K2”“K3”“K4”或“K5”,下同),其余均打开;待“气球1”中收集到足够多的CO2时,关闭______,其余均打开。
③三口烧瓶中物质发生反应生成KMnO4的同时还会生成MnO2和K2CO3,该反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用无机矿物资源生产部分材料,其产品流程示意图如下,下列说法正确的是( )

A. 制取粗硅时生成的气体产物为CO2
B. 生产铝、铜、高纯硅及玻璃的过程中都涉及氧化还原反应
C. 电解精炼铜时,当电路中转移0.2mol电子时阳极质量减轻6.4g
D. 粗硅制高纯硅时,提纯四氯化硅可用多次分馏的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.实验室中常用排饱和食盐水的方法收集Cl2
B.洗涤油污时热的纯碱溶液比冷的纯碱溶液效果更好
C.浓氨水中加入氢氧化钠固体时产生刺激性气味的气体
D.工业上使用催化剂提高SO2与O2合成SO3的效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+3、+5、+7,核电荷数按照Z、X、Y、W的顺序增大。已知Z的原子次外层的电子数为2,W、X原子次外层电子数为8。
(1)请写出元素Y的原子结构示意图_______________;其中元素W在周期表中的位置_______________________________。
(2)用电子式表示X在空气中生成的氧化物的形成过程:__________________________。
(3)X、Y、Z、W的原子半径由大到小的顺序为:_____________________________。(用元素符号表示)
(4)请写出W的单质与X的最高价氧化物对应水化物反应的离子方程式:_______________________________。
(5)写出Z与氢元素形成的10电子微粒化学式_____________________(任写两种)。
(6)元素X与元素Y相比,金属性较强的是_____(用元素符号表示),请举一例实验事实证明这一结论__________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com