
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)═CH3OH(g)+H2O(g) | K3 | ||
| 5×5 |
| 33×1 |


科目:高中化学 来源: 题型:
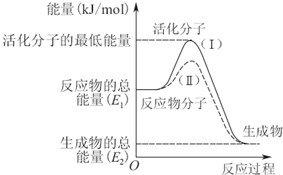 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示.请认真观察图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示.请认真观察图,然后回答问题.| 1 |
| 2 |
| 化学键 | N-H | N-N | O═O | N≡N | O-H |
| 键能(kJ?mol-1) | 386 | 167 | 498 | 946 | 460 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L也能与Z的水溶液反应生成盐;丙、戊可组成化合物M.请回答下列问题:
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L也能与Z的水溶液反应生成盐;丙、戊可组成化合物M.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
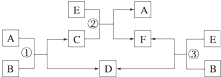 已知A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出.试回答下列问题:
已知A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| a |
| b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4 L |
| B、44.8 L |
| C、11.2 L |
| D、4.48 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
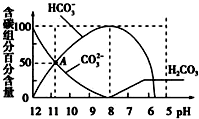 常温下,在20mL 0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.下列说法不正确的是( )
常温下,在20mL 0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.下列说法不正确的是( )| A、0.1mol/L Na2CO3溶液中c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
| B、在A点:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| C、常温下CO2饱和溶液的pH约为5.6 |
| D、0.05mol/L NaHCO3溶液的pH=8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com