
| t(s) | 200 | 400 | 800 |
| c(A)(mol?L-1) | 1.45 | 1.28 | 1.00 |
| c(B)(mol?L-1) | 0.38 | 0.72 | 1.28 |
| c(C)(mol?L-1) | 0.095 | 0.18 | 0.32 |
| △c |
| △t |
| △c |
| △t |
| △c |
| △t |
| ||
| 60 |
| △c |
| △t |
| 0.32-0.18 |
| 800-400 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
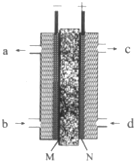 甲醇是燃料电池的常见原料,现已熔融的K2CO3为电解质,以甲醇为燃料,空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.如图是甲醇燃料电池模型,试回答下列问题:
甲醇是燃料电池的常见原料,现已熔融的K2CO3为电解质,以甲醇为燃料,空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.如图是甲醇燃料电池模型,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯的结构简式可以表示为CH2CH2 |
| B、液化石油气和天然气的主要成分都是甲烷 |
| C、甲烷和乙烯都可以与氯气反应 |
| D、乙烯可以与氢气发生加成反应,苯不能与氢气加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com