
【题目】臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是___________和_________(填分子式)。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为0.0216 mol/L。
| 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的是___________.。
②在30°C、pH=4.0条件下,O3的分解速率为__________ mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为______.(填字母代号)
a. 40°C、pH=3.0 b. 10°C、pH=4.0 c. 30°C、pH=7.0
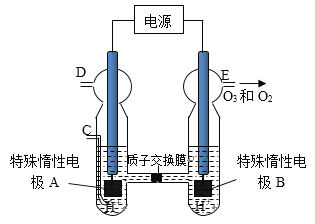
(3)O3 可由臭氧发生器(原理如图)电解稀硫酸制得。
①图中阴极为_________(填“A”或“B”),其电极反应式为_________________.
②若C处通入O 2 ,则A极的电极反应式为_____________________.
③若C处不通入O 2 ,D、E处分别收集到xL和有yL气体(标准状况),则E处收集的气体中O 3 所占的体积分数为__________.(忽略O 3 的分解)。
【答案】 I2 O2 OH- 1.00×10-4 b、a、c A 2H++2e-=H2↑ O2+4H++4e-=2H2O ![]()
【解析】(1)因为O3是一种强氧化剂,KI具有还原性,所以二者反应生成I2和O2;
(2) O3的起始浓度为0.0216 mol/L,O3在水中分解生成O2,分析表中数据可知,①随pH的增大,O3分解速率加快,说明对O3分解起催化作用的是OH-;②在30°C、pH=4.0条件下,O3的分解一半所需要的时间为108min,所以其分解速率为ν(O3)= ![]() ;③根据表中的递变规律,推测O3在40°C、pH=3.0时,分解一半需要的时间大约为70分钟左右,在10°C、pH=4.0时分解一半需要的时间大约为460分钟左右,在30°C、pH=7.0时分解一半需要的时间大约为4分钟左右,所以O3的分解速率依次增大的顺序为b<a<c;
;③根据表中的递变规律,推测O3在40°C、pH=3.0时,分解一半需要的时间大约为70分钟左右,在10°C、pH=4.0时分解一半需要的时间大约为460分钟左右,在30°C、pH=7.0时分解一半需要的时间大约为4分钟左右,所以O3的分解速率依次增大的顺序为b<a<c;
(3)电解稀硫酸,实质是电解水,只有OH—在阳极放电才能生成O 2,进而转化为O3。①由装置图可知电极B为阳极,则电极A为阴极,其电极反应式为2H++2e-=H2↑;②若C处通入O2 ,则A极的电极反应式为4H++O2 +4e- =2H2O;③在相同条件下,气体的体积之比等于物质的量之比,设D处收集的H2为xmol,则E处收集的O2和O3共ymol,所以电解过程中转移电子2xmol,设E处收集的气体中O3为amol,则O2为(y-a)mol,由电子转移守恒可得6a+4(y-a)=2x,a=(x-2y)mol,所以O 3 所占的体积分数为![]() 。
。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C.78g苯中含有的碳碳双键数目为3NA
D.1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)2SO3(g)△H=﹣Q kJmol﹣1(Q>0),某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )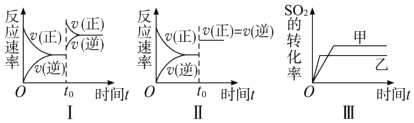
A.图Ⅰ研究的是t0时刻增大O2的浓度对反应速率的影响
B.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低
C.图Ⅲ研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D.图Ⅱ研究的是t0时刻加入催化剂后对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有xMm﹣和yNn+两种简单离子,它们的电子层结构相同.则表示M元素质子数的正确表达式是( )
A.x=y﹣n﹣m
B.x=y+n+m
C.x=y+n﹣m
D.x=y﹣n+m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用铁片与稀硫酸反应制氢气.下列措施中,不能使氢气生成速率加大的是( )
A.加热
B.不用稀硫酸,改用98%浓硫酸
C.将铁片改为镁条
D.不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行下列反应:M(气)+N(气)R(气)+2L(?)此反应符合下面图象,下列叙述正确的是( )
A.正反应放热,L是气体
B.正反应吸热,L是固体
C.正反应吸热,L是气体
D.正反应放热,L是固体或液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿(主要成分是MnO2)与浓盐酸混合加热,产生了氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:

(1)A仪器的名称是__________
(2)漂白粉将在U形管中产生,其化学方程式是____________________。
(3)此实验结果所得Ca(ClO)2产率太低,经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是______________________________。
②试判断另一个副反应(写出此反应方程式):____________________。
(4)漂粉精同盐酸作用产生氯气:Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O,该反应中每生成1molCl2,转移电子的物质的量为__________mol。
(5)有效氯是漂粉精中有效Ca(ClO)2的含量大小的标志。已知:有效氯=(漂粉精加盐酸所释放出的氯气的质量/漂粉精的质量)![]() 100%,该漂粉精的有效氯为65%,则该漂粉精中Ca(ClO)2的质量分数为__________(保留一位小数)
100%,该漂粉精的有效氯为65%,则该漂粉精中Ca(ClO)2的质量分数为__________(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,以制取乙酸乙酯。
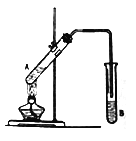
(1)试管A中的液体由以下试剂混合而成:①2mL乙醇;②3mL浓硫酸;③2mL 乙酸。一般况下,这三种试剂的加入顺序是:先加入________(填序号,下同),再加入_________,最后加入③。
(2)为防止试管A中的液体在实验时发生暴沸,在加热前还应加入碎瓷片。若加热后发现未加入碎瓷片,应采取的补救措施是:_________________________________________________________。
(3)试管B中盛放的试剂是___________________;反应结束后,分离B中的液体混合物需要用到的玻璃仪器主要是_____________。试管B中的导管末端不伸入液面下方的目的是_______________。
(4)试管 A中CH3COOH与C2H518OH反应的化学方程式为:___________________________________。
(5)该实验中用30gCH3COOH与46gC2H5OH反应,如果实际得到的乙酸乙酯的质量是26.4g,该实验中乙酸乙酯的产率是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com