
| 温度 试剂 | T1/℃ | T2/℃ | T3/℃ |
| Na2CO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
| 溶解度 温度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 40.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
分析 (1)碳酸钠为强碱弱酸盐,碳酸根离子水解导致溶液呈碱性;
(2)根据溶解度分别求出10mL水(20℃)分别溶解的Na2CO3、NaHCO3固体与0.5g作比较分析;
(3)分析表1的数据得出:T1/℃,Na2CO3固体溶于水温度升高,NaHCO3固体溶于水温度降低;
(4)需探究盐酸溶于水温度的变化;
(5)A.分析表1的数据得出NaHCO3与盐酸的反应是吸热反应;
B.Na2CO3和NaHCO3固体二者与酸反应的快慢不同;
C.从温度变化可判别Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关;
D.利用上述实验数据只能计算:CO32-(aq)+2H+(aq)=H2O(l)+CO2(g)的温度变化;
(6)根据质量守恒定律,由加热前后剩余物质的质量差可求得分解反应出二氧化碳与水的质量即固体减少的质量,由固体减少的质量根据化学方程式计算出样品中碳酸氢钠质量,并进一步计算样品中碳酸氢钠的质量分数.
解答 解:(1)碳酸钠为强碱弱酸盐,钠离子不水解、碳酸根离子水解导致溶液呈碱性,水解离子方程式为:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,
故答案为:CO32-+H2O?HCO3-+OH-;HCO3-+H2O?H2CO3+OH-;
(2)10mL水(20℃)溶解Na2CO3固体质量为:m=$\frac{10mL}{100mL}$×21.5g=2.15g>0.5g,10mL水(20℃)溶解NaHCO3固体质量为:m=$\frac{10mL}{100mL}$×9.6g=0.96g>0.5g,0.5gNa2CO3、NaHCO3固体都是全部溶解,
故答案为:Na2CO3、NaHCO3固体都是全部溶解;
(3)分析表1的数据得出:T1/℃,Na2CO3固体溶于水温度从20℃升高到23.3℃,放热,NaHCO3固体溶于水温度从20℃升高到18.5℃,吸热,
故答案为:放热;吸热;
(4)强酸溶于水放热,盐酸为强酸,所以需增加探究盐酸溶于水温度的变化,即10mL密度约为1.1g/mL20%的盐酸搅拌,测量温度为22.2℃,
故答案为:10mL密度约为1.1g/mL20%的盐酸;
(5)A.盐酸溶于水放热,测量温度为22.2℃,T1/℃,NaHCO3固体溶于水温度从20℃升高到18.5℃,吸热,两者反应恒温后测量温度T3为20.8℃低于22.2℃,所以NaHCO3与盐酸的反应是吸热反应,故A正确;
B.用稀盐酸鉴别NaHCO3和Na2CO3溶液,反应较快的为NaHCO3,能鉴别,故B错误;
C.从上述温度变化数值可判别Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关,故C正确;
D.反应热(△H)=生成物的总能量-反应物的总能量,利用上述实验数据只能计算:CO32-(aq)+2H+(aq)=H2O(l)+CO2(g)的温度变化,无法计算△H,故D错误;
故选AC;
(6)设样品中碳酸氢钠的质量为x.
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O↑+CO2↑ 固体质量减少
168 106 168-106=62
x m1-m2
$\frac{168}{62}$=$\frac{x}{m_{1}-m_{2}}$ x=$\frac{84(m_{1}-m_{2})}{31}$样品中碳酸氢钠的质量分数=$\frac{84(m_{1}-m_{2})}{31m_{1}}$×100%
故答案为:=$\frac{84(m_{1}-m_{2})}{31m_{1}}$×100%.
点评 本题考查探究Na2CO3和NaHCO3的性质的检验,抓住题干信息以及Na2CO3和NaHCO3的性质是解答本题的关键,注意物质性质的差异,题目难度中等.


 同步轻松练习系列答案
同步轻松练习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝罐可久盛食醋 | |
| B. | 氢氧化铝可作胃酸的中和剂 | |
| C. | 铁表而镀锌可以增强其抗腐蚀性 | |
| D. | 含重金属离子的电镀废液不能随意排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a<c<0 | B. | b>d>0 | C. | 2a=b<0 | D. | 2c=d>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
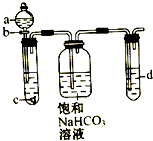 某同学为了探究元素非金属性递变规律,设计了如图所示实验装置.
某同学为了探究元素非金属性递变规律,设计了如图所示实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
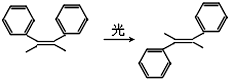
| A. | 分子式相同,互为同分异构体 | |
| B. | 均可发生加聚反应、氧化反应 | |
| C. | 均含有苯环,都是苯的同系物 | |
| D. | 分子中所有碳原子均可能处于同一平面上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com