
|
常温下,下列溶液中微粒浓度关系一定正确的是 | |
| [ ] | |
A. |
氨水与氯化铵的pH=7的混合溶液中:C(Cl-)>C(NH4+) |
B. |
pH=2的一元酸和pH=12的一元强碱等体积混合:C(OH-)=C(H+) |
C. |
0.1 mol·L-1的硫酸铵溶液中:C(NH4+)>C(SO42-)>C(H+) |
D. |
0.1 mol·L-1的硫化钠溶液中:C(OH-)=C(H+)+C(HS-)+C(H2S) |
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
| 酸或碱 | 电离平衡常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×1010 |
| HClO | 3×10-8 |
| NH2?H2O | 1.8×10-5 |
| 难(微)溶物 | 深度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 7×10-5 |
| CaCO3 | 5×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3·H2O | 1.8×10-5 |
表1
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 7×10-5 |
| CaCO3 | 5×10-9 |
表2
请回答下面问题:
(1)上述四种酸中,酸性最强的是 (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是 (填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈 (选填“酸性”、“中性”、“碱性”),溶液中各离子浓度大小的关系是 。
(3)物质的量l:l的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为 。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0。0lmol·L-1以上,则溶液中CO32-物质的量浓度应≥ mol·L-1
查看答案和解析>>
科目:高中化学 来源:2012届浙江省东阳中学高三下学期阶段检测化学试卷 题型:填空题
描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3·H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 7×10-5 |
| CaCO3 | 5×10-9 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省高三下学期阶段检测化学试卷 题型:填空题
描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
|
酸或碱 |
电离常数(Ka或Kb) |
|
CH3COOH |
1.8×10-5 |
|
HNO2 |
4.6×10-4 |
|
HCN |
5×10-10 |
|
HClO |
3×10-8 |
|
NH3·H2O |
1.8×10-5 |
表1
|
难(微)溶物 |
溶度积常数(Ksp) |
|
BaSO4 |
1×10-10 |
|
BaCO3 |
2.6×10-9 |
|
CaSO4 |
7×10-5 |
|
CaCO3 |
5×10-9 |
表2
请回答下面问题:
(1)上述四种酸中,酸性最强的是 (用化学式表示)。下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是 (填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈 (选填“酸性”、“中性”、“碱性”),溶液中各离子浓度大小的关系是 。
(3)物质的量l:l的NaCN和HCN的混合溶液,其pH>7,该溶液中离子的浓度从大到小排列为 。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0。0lmol·L-1以上,则溶液中CO32-物质的量浓度应≥ mol·L-1
查看答案和解析>>
科目:高中化学 来源:陕西省模拟题 题型:填空题

 CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。 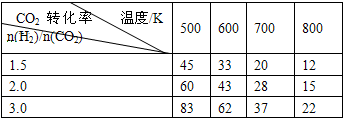

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com