
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
【答案】D
【解析】
A.根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;平衡常数只与温度有关,温度不变,平衡常数不变;
B.增大压强,平衡向气体体积减小的方向移动;
C.根据v=![]() 进行计算;
进行计算;
D.计算出此时的Qc与K比较,判断反应进行的方向。
PCl5(g)![]() PCl3(g)+Cl2(g),
PCl3(g)+Cl2(g),
A.I中K=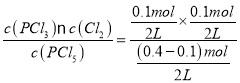 ≈0.03mol/L,平衡常数只与温度有关,温度不变,平衡常数不变,则容器Ⅱ中得到平衡常数与容器I中相同,容器III中K=
≈0.03mol/L,平衡常数只与温度有关,温度不变,平衡常数不变,则容器Ⅱ中得到平衡常数与容器I中相同,容器III中K=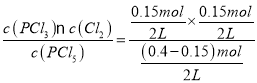 =0.045mol/L,即平衡常数K:容器Ⅱ<容器Ⅲ,A错误;
=0.045mol/L,即平衡常数K:容器Ⅱ<容器Ⅲ,A错误;
B.容器Ⅱ与容器Ⅰ相比,相当于增大压强,增大压强,化学平衡气体体积减小的逆反应方向移动,PCl5的转化率减小,即PCl5的转化率:容器Ⅱ<容器Ⅰ,B错误;
C.对于容器I,反应到达平衡时,反应的PCl5的物质的量为0.1mol,故v(PCl5)=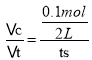 =
=![]() mol/(Ls),C错误;
mol/(Ls),C错误;
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则此时Qc=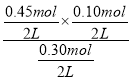 =0.075mol/L>0.045mol/L,所以化学平衡向逆反应方向移动,D正确;
=0.075mol/L>0.045mol/L,所以化学平衡向逆反应方向移动,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】用下面的方案进行某些离子的检验,其中方案设计严密的是
A. 检验试液中的SO42-:试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
B. 检验试液中的SO32-:试液![]() 气体
气体![]() 褪色
褪色
C. 检验试液中的I-:试液![]() 棕黄色溶液
棕黄色溶液![]() 蓝色溶液
蓝色溶液
D. 检验试液中的CO32-:试液![]() 白色沉淀
白色沉淀![]() 沉淀溶解
沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要产物之一,其产量常用于衡量一个国家石油化工发展水平的标志。下列是有机物A~G 之间的转化关系:
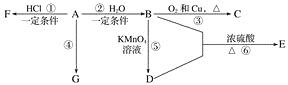
请回答下列问题:
(1)A的官能团的名称是_____;C的结构简式是_____。
(2)E是一种具有香味的液体,由B+D→E的反应方程式为_______,
(3)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质F(沸点12.27℃)进行应急处理。写出由A制F的化学方程式:________。
(4)E的同分异构体能与NaHCO3溶液反应,写出该同分异构体的结构简式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是( )

A.放电时,甲电极为正极,OH-移向乙电极
B.放电时,乙电极反应为:Ni(OH)2+OH-—e-=NiO(OH)+H2O
C.充电时,电池的碳电极与直流电源的正极相连
D.电池总反应为H2+2NiOOH![]() 2Ni(OH)2
2Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体。向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:
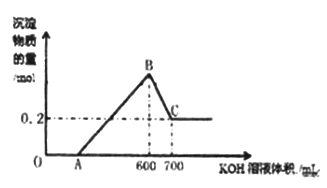
(1)OA对应反应的离子方程式为________________,BC对应反应的离子方程式为_________________;
(2)c(KOH)=_________mol/L,混合物中氧化铝的物质的量为_____mol;
(3)A点对应的数值为_______;
(4)在中学阶段,实验室里检验B点对应的溶液中的阳离子时,所观察到的现象是___________。
(5)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) =CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) =2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) =2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
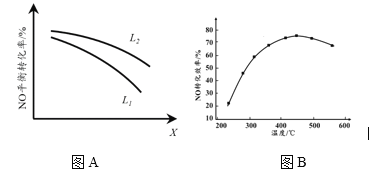
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系______,并简述理由:______________________________。
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______(填“>”、“<”或“=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =___________。(保留一位小数)
II. 有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率______(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是________________________;高于450OC时,NO的转化率降低的可能原因是___________(填标号)
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率______(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是________________________;高于450OC时,NO的转化率降低的可能原因是___________(填标号)
A.催化剂活性降低 B.平衡常数变小 C. 反应活化能增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa的条件下,断裂1 molH—H键吸收436 kJ能量,断裂1mol Cl—Cl键吸收243kJ能量,形成1 molH—Cl键放出431 kJ能量。
H2+Cl2===2HCl的化学反应可用如图表示:
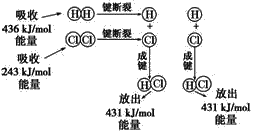
请回答下列有关问题:
(1)反应物断键吸收的总能量为____。
(2)生成物成键放出的总能量为____。
(3)1molH2和1molCl2反应生成2molHCl是_____(填“吸收”或“放出”)能量的反应,其能量值为____。
(4)反应物总能量___(填“>”或“<”)生成物总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包围在冰晶之间,形成“盐泡”,其大致结构如图所示。若海冰的冰龄达到1年以上,融化后的水为淡水。下列叙述正确的是
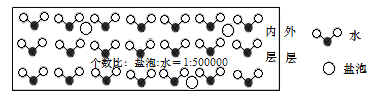
A.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在
B.海冰内层“盐泡”越多,密度越小
C.海冰冰龄越长,内层的“盐泡”越少
D.若冰的密度为0.9g·cm﹣3,则海冰内层NaCl的浓度约为10-4mol·L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)常作供氢剂,遇水蒸气剧烈反应。某小组设计如下实验制备氢化钙。下列说法错误的是( )
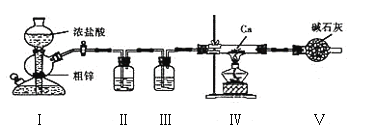
A. 装置I不可用于二氧化锰与浓盐酸反应制取氯气
B. 装置III、V所起作用相同
C. 直玻璃管加热前,用试管在末端收集气体并验纯
D. 试验结束后,可通过取样加水,根据气泡判断是否有CaH2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com