
设NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 1.00mol NaCl中含有NA个NaCl 分子
B. 常温常压下,22.4LCl2与足量镁粉反应,转移的电子数为2NA
C. 一定条件下,2.3gNa与足量O2完全反应生成3.6g产物时失去的电子数为0.1NA
D. 28g乙烯和环丙烷(C3H6)组成的混合气体中含有氢原子的个数为3 NA
科目:高中化学 来源:2016-2017学年湖南省高一下学期第一次模块考试化学试卷(解析版) 题型:选择题
Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液态)这些物质为什么归为一类,下列哪些物质还可以和它们归为一类 ( )
A. 75%的酒精溶液 B. 硝酸钠 C. Fe(OH)3胶体 D. 豆浆
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三3月高考适应性测试理综化学试卷(解析版) 题型:简答题
砷化稼(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)基态Ga原子的核外电子排布式为[Ar]_______________。
(2)根据元素周期律,元素的电负性Ga______(填“大于”或“小于”, 下同)As,第一电离能B ____ Ga;BF3和NH3的分子能够通过配位键相结合的原因是_______。
(3)杀虫剂Na3AsO4中阴离子的空问构型为______,As原子采取________杂化。
(4)组成相似的GaF3和GaCl3晶体,前者属于离子晶体,后者属于分子晶体。从F-和Cl-结构的不同分析其原因是____________。
(5)原子晶体GaAs的晶胞参数a=xpm,它的晶胞结构如下图所示。该晶胞内部存在的共价健数为______;A原子距离B原子所在六面体的侧面的最短距离为______ (用x表示)pm ;该晶胞的密度为_____g·cm-3。(阿伏伽德罗常数用NA表示)。
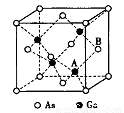
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三第二次质检化学试卷(解析版) 题型:选择题
下列实验装置中能达到实验目的是
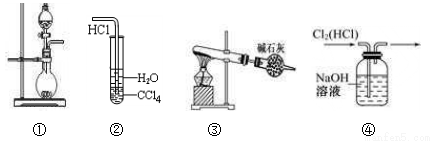
A. 图①可用于制取少量NH3或用MnO2和浓盐酸制取Cl2
B. 装置②可用于氯化氢气体溶于水
C. 以NH4Cl为原料,装置③可用于实验室制备少量干燥的NH3
D. 装置④可用于除去Cl2中的HCl
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三第二次质检化学试卷(解析版) 题型:选择题
根据如图的转化关系判断下列说法正确的是(反应条件已略去)
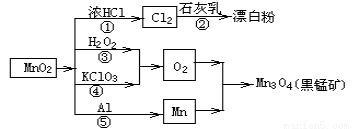
A. 反应①②③④⑤均属于氧化反应和离子反应
B. 反应⑤说明该条件下铝的还原性强于锰
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1
D. 反应①中氧化剂与还原剂的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源:2016~2017学年江苏省宿迁市高二学业水平测试模拟(二)化学试卷(解析版) 题型:选择题
某溶液中可能含有Fe2+、NH4+、Fe3+、SO42-、Cl-中的两种或多种。下列结论正确的是
A. 取少量溶液,向其中滴加AgNO3溶液,若有白色沉淀生成,则说明一定含有Cl-
B. 取100 mL溶液,加入足量的NaOH溶液并加热,收集到标准状况下33.6 mL的气体,则c(NH4+)=0.0015 mol·L-1
C. 经测定一定量的该溶液中n(NH4+)=0.02 mol,n(Fe2+)+n(Fe3+)=0.02 mol,则该一定量的溶液中0.06 mol≤n(Cl-)≤0.08 mol
D. 取10 mL该溶液,通入标准状况下Cl2 22.4 mL恰好完全反应。然后调节pH,使溶液中的铁元素全部转化为沉淀,经过滤、洗涤、灼烧,冷却后称重,得固体质量为0.32 g,则溶液中c(Fe3+)=0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016~2017学年江苏省宿迁市高二学业水平测试模拟(二)化学试卷(解析版) 题型:选择题
Mg—AgCl电池是一种以海水为电解质溶液的水激活电池,电池总反应为Mg+2AgCl===MgCl2+2Ag。下列有关该电池说法错误的是
A. 镁为负极 B. AgCl发生了还原反应
C. 电池工作时电能转化为化学能 D. 可用于海上应急照明供电
查看答案和解析>>
科目:高中化学 来源:2017届湖北省七市(州)高三第一次联合调考(3月联考)理科综合化学试卷(解析版) 题型:推断题
已知:A、B、C、D四种元素,原子序数依次增大。A是短周期中原子半径最大的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素。试回答下列有关的问题:
(1)写出D元素价电子的电子排布式:______________。
(2)D可形成化合物[D(H2O)6](NO3)3 。
①[D(H2O)6](NO3)3中阴离子的立体构型是_____________。NO3-中心原子的轨道杂化类型为__________。
②在[D(H2O)6] 3+中D3+与H2O之间形成的化学键称为______,1 mol [D(H2O)6] 3+ 中含有的σ键有________mol。
(3)已知B、C两种元素形成的化合物通常有两种。这两种化合物中________(填化学式)为非极性分子。另一种物质的电子式为_____________。
(4)由A、C两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为A、C形成化合物的晶胞结构图以及晶胞的剖面图:
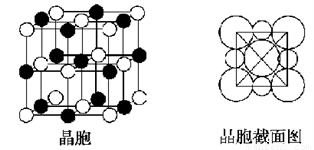
晶胞中距离一个A+最近的C-有________个,这些C-围成的图形是______________,若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,则A+的离子半径为________cm(用含NA与ρ的式子表达)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省漳州市高二上学期期末考试化学试卷(解析版) 题型:选择题
一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是
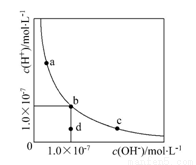
A. 升高温度,可能引起由c向b的变化
B. 该温度下,水的离子积常数为1.0×10-13
C. 该温度下,加入FeCl3可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com