
【题目】各取n mol的Na、Mg、Al分别与含有lmol HCl的盐酸反应,若Mg和Al产生氢气的物质的量相等且大于钠产生氢气的物质的量,则n的取值范围是
A. n>1 B. n=1 C. 0.5≦n<1 D. n<0.5
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要成分为Al2O3和SiO2,还含有少量的FeO、Fe2O3等)为原料制备Al2O3的流程如下:

(1)“酸浸”时需加入过量的稀硫酸,目的是提高浸取率和________;滤渣的主要成分是__________。
(2)“氧化”过程中,加入H2O2发生反应的离子方程式为____________。
(3)“提纯”过程中,当加入NaOH溶液达到沉淀量最大时,溶液中c(SO42-)∶c(Na+)=_________。
(4)已知Ksp[Fe(OH)3]=1×10-39。“提纯”过程中,当c(Fe3+)<10-6 mol ·L-1时,溶液中c(OH-)>________mol ·L-1。
(5)“沉淀”过程中,通入过量CO2时发生反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】获得中科院“百人计划”和“863”计划支持的环境友好型铝碘电池是以AlI3溶液为电解质溶液,以金属铝和附有碘单质的石墨为电极形成的原电池。已知电池总反应为2Al+3I2═2AlI3.下列说法不正确的是
A.电池工作时,溶液中的铝离子向正极移动
B.该电池可能是一种可充电的二次电池
C.消耗相同质量金属时,用锂做负极时,产生电子的物质的量比铝多
D.该电池负极的电极反应为:Al﹣3e﹣═Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲烷在一定条件下可生成以下微粒:
A. 碳正离子(CH3+ ) B.碳负离子(CH3—)C. 甲基 (﹣CH3) D.碳烯 (:CH2)
①四种微粒中,键角为120°的是_____(填序号).
②碳负离子(CH3—)的空间构型为______,与CH3—互为等电子体的一种分子是__(填化学式)
(2)在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学方程式为(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac.请回答下列问题:
①该反应中含有的第二周期非金属元素的第一电离能由大到小的顺序为_________.
②写出基态Cu2+的价电子排布式_____________.
③化合物Cu(NH3)3(CO)Ac中,金属元素的化合价为___________.
④在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为__;1mol尿素分子中,σ 键的数目为______________.
⑤Cu与O元素形成的某种化合物的晶胞结构如图所示,若阿伏伽德罗常数为NA,晶胞的边长为a pm,则氧元素对应的离子在该晶胞中的坐标是_____,该晶体的密度为__gcm﹣3.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:

(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是___________。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是_________________,说明该反应属于_________(填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是________________;
②若观察到烧杯里产生气泡,则说明M溶于水____________(填“一定是放热反应”“一定是吸热反应”或“可能是放热反应”);
③若观察到烧杯里的玻璃管内形成一段水柱,则M可能是______。
(4)至少有两种实验方法能证明超氧化钾与水的反应(4KO2+2H2O = 4KOH+3O2↑)是放热反应还是吸热反应。
方法(1):选择上述装置________(填“Ⅰ”“Ⅱ”或“Ⅲ”)进行实验;
方法(2):取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是_____________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
(一)硒元素(selenium)是第四周期、第VIA族元素,单质有红硒、黑硒和灰硒,其中灰硒有良好的导热导电性,且有显著的光电效应,可应用于光电半导体材料。请回答下列问题:
(1)Se原子的核外电子排布式为[Ar]_____。
(2)As和Se是同一周期的元素,As的第一电离能比Se大,原因是______。SeO42-中Se―O的键角比SeO3的键角________(填“大”或“小”)。
(3)H2Se比H2S水溶液的酸性强,原因是_____,____。
(4)灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图和晶胞俯视图如下。

螺旋链中Se原子的杂化方式为____________。
(二)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色Cu2O,其晶胞结构如图所示。

①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(1/2,1/2,1/2)。则D原子的坐标参数为_________,它代表铜原子。
②若Cu2O晶体密度为d g·cm-3,晶胞参数为a pm,则阿伏加德罗常数值NA=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氢氧化铁胶体中逐滴滴入下列某种溶液,出现的现象是先沉淀后沉淀溶解。这种溶液是
A.稀硫酸 B.饱和硫酸镁溶液
C.氯化钡溶液 D.饱和硫酸铵溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由二氧化硅制高纯硅的流程如下,下列判断中错误的是
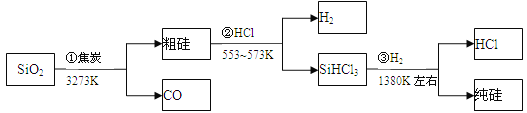
A. ①②③均属于氧化还原反应 B. H2和HCl均可循环利用
C. SiO2是一种坚硬难熔的固体 D. SiHCl3摩尔质量为135.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A—I在周期表中的位置,用元素符号或化学式回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)中元素,化学性质最不活泼的是 ,只有负价而无正价的是 ,氧化性最强的单质是 ,还原性最强的单质是 ;
(2)最高价氧化物的水化物中碱性最强的是 ,酸性最强的是 ,呈两性的是 ;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的 ;
(4)在B、C、D、E、F、G、H中,原子半径最大的是 .最小的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com