
| A. | ①②④⑤⑥⑦⑧ | B. | ②⑤⑥⑦⑨ | C. | ②④⑤⑥⑦⑧ | D. | ③④⑤⑥⑦⑧ |
分析 铝在人体内积累可使人慢性中毒,铝进入人体的主要途径是通过消化系统.
解答 解:①制铝锭,人的消化系统不直接接触,对人体无影响,故不选;
②制易拉罐,饮料上粘的铝能通过消化系统或呼吸系统进入人体,所以正确.
③铝作电线电缆与人的消化系统不直接接触,铝不会因使用电缆进入人体,所以错误.
④牙膏皮上的铝能随通过消化系统进入人体,所以正确.
⑤明矾净水后,饮用水中的铝元素能通过消化系统或呼吸系统进入人体,所以正确.
⑥铝作制炊具,铝会随食物通过消化系统或呼吸系统进入人体,所以正确.
⑦用明矾和苏打混合作食品膨化剂,食品中的铝元素能通过消化系统或呼吸系统进入人体,所以正确.
⑧服氢氧化铝胶囊,较多的铝会被摄入,所以正确.
⑨制防锈漆,正常情况下铝与人的消化系统不直接接触,铝不会因使用电缆进入人体,所以错误.
故选C.
点评 关爱生命,拥抱健康”是人类追求的永恒主题,对营养元素与人体健康的考查也就成了热点之一,特别是元素的分类、元素的生理功能和对人体的影响等内容.


科目:高中化学 来源: 题型:多选题
| A. | 其溶液中由水电离出的c(H+)的大小关系是 ①=②>③>④>⑤ | |
| B. | 其溶液中由水电离出的(H+)的大小关系是 ④>③>①=⑤>② | |
| C. | 上述溶液中能能促进水的电离是②>①=>⑤>③ | |
| D. | 上述溶液中能促进水的电离是只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度、溶解度、物质 | (NH4)2SO4 | FeSO4•7H2SO4 | 硫酸亚铁铵晶体 |
| 10 | 73.0 | 40.0 | 18.1 |
| 20 | 75.4 | 48.0 | 21.1 |
| 30 | 78.0 | 60.0 | 24.5 |
| 40 | 81.0 | 73.3 | 27.9 |
| 50 | 84.5 | - | 31.3 |
| 70 | 91.9 | - | 38.5 |
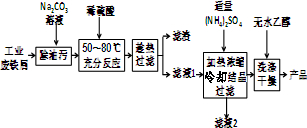
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
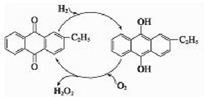 氧元素性质活泼,在众多的含氧化合物中氧元素显-2价,但也能形成一定数量的显正价的化合物.
氧元素性质活泼,在众多的含氧化合物中氧元素显-2价,但也能形成一定数量的显正价的化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
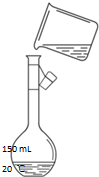 实验室用氯化钠固体配制1.00mol/L的NaCl溶液100mL,回答下列问题:
实验室用氯化钠固体配制1.00mol/L的NaCl溶液100mL,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ab}{5}$×100% | B. | $\frac{2ab}{5}$×100% | C. | $\frac{2ab}{5b}$×100% | D. | $\frac{ab}{5a}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、Na+、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$ | B. | Na+、Cl-、NH${\;}_{4}^{+}$、SO${\;}_{4}^{2-}$ | ||
| C. | K+、Cl-、HCO${\;}_{3}^{-}$、H+ | D. | Ca2+、Na+、Fe3+、NO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | M | R |
| A. | 元素的非金属性次序为:Y>X>M | |
| B. | 气态氢化物稳定性:M>R | |
| C. | Z的氧化物可以做光导纤维 | |
| D. | 最高价氧化物对应水化物的酸性:Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COO-的水解方程式:CH3COO-+H2O?CH3COOH+OH- | |
| B. | HCO3-的水解方程式:HCO3-+H2O?CO32-+H3O+ | |
| C. | CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- | |
| D. | Fe3+的水解方程式:Fe3++3OH-?Fe(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com