
下列离子方程式正确的是
A.FeSO4酸性溶液暴露在空气中: 4Fe2++O2+4H+ 4Fe3++2H2O
4Fe3++2H2O
B.过量石灰水与碳酸氢钙反应:Ca2++2HCO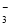 +2OH-===CaCO3↓+CO
+2OH-===CaCO3↓+CO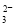 +2H2O
+2H2O
C.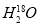 中投入Na2O2固体:2
中投入Na2O2固体:2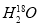 +2Na2O2===4OH-+4Na++18O2↑
+2Na2O2===4OH-+4Na++18O2↑
D.向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O===AlO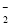 +4NH
+4NH +2H2O
+2H2O
科目:高中化学 来源:2015届浙江省杭州市高三10月月考化学试卷(解析版) 题型:选择题
经氯气消毒的自来水,若用于配制以下溶液:①NaOH ②AgNO3 ③Na2CO3 ④FeSO4 ⑤ KI ⑥Na2S ⑦Na2SO3,会使配制的溶液变质的是
A.全部 B.②④⑤⑥⑦ C.①②⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第二次质量检测化学试卷(解析版) 题型:选择题
常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如下图所示:
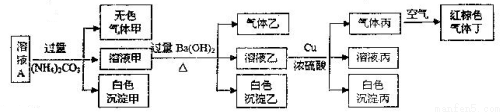
下列有关说法正确的是
A.该溶液中一定有NO3-、Al3+、SO42-、Cl-四种离子
B.实验消耗Cu14.4g,则生成气体丁的体积为3.36L
C.沉淀乙一定有BaCO3,可能有BaSO4
D.为确定原溶液中是否有K+,可通过焰色反应直接观察焰色是否为紫色来确定
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第二次质量检测化学试卷(解析版) 题型:选择题
下列说法正确的是
A.酸性氧化物都是非金属氧化物
B.碱性氧化物都是金属氧化物
C.由同种元素构成的物质一定属于纯净物
D.难溶于水的电解质一定是弱电解质
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第一次统练化学试卷(解析版) 题型:填空题
(16分) A是有机羧酸盐HCOONa,B、C、D是常见化合物;A、B、C、D焰色反应呈黄色,水溶液均呈碱性,其中B的碱性最强。X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同。C受热分解得到Y、D和X;B与C反应生成D和X。E由两种元素组成,相对分子质量为83,将E投入X中得到B和气体Z,Z在标准状况下的密度为0.76g·L-1。
(1)E晶体中含有的化学键是 。Y的电子式是 。
(2)X的沸点比同主族同类型物质要高,原因是 。
(3)写出E与X反应的化学方程式 。
(4)写出在D的饱和溶液中不断通Y析出C的离子方程式 。
B与C反应生成D和X的离子方程式
(5)A的一个重要应用是根据2A→P+H2↑得到P,P溶液中的阴离子通常用CaC12使之沉淀,P的化学式 ,此反应是不是氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第一次统练化学试卷(解析版) 题型:选择题
已知NH4CuSO3与足量的1mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法合理的是
A.NH4CuSO3中硫元素被氧化了
B.刺激性气味的气体是二氧化硫或氨气
C.该反应中NH4CuSO3既是氧化剂又是还原剂
D.该反应中硫酸既表现为酸性又表现氧化性
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第一次统练化学试卷(解析版) 题型:选择题
甲、乙、丙是三种不含相同离子的可溶性强电解质。它们所含离子如下表所示,取等质量的三种化合物配制相同体积的溶液,其溶质物质的量浓度:c(甲)>c(乙)>c(丙),则乙物质可能是
阴离子 | OH-、NO | 阳离子 | NH |
①MgSO4 ②NaOH ③(NH4)2SO4 ④Mg(NO3)2 ⑤NH4NO3
A.①② B.③④ C.③⑤ D.①⑤
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:选择题
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g) △H=一92.6kJ/mol。实验测得起始、平衡时的有关数据如下表:
2NH3(g) △H=一92.6kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器
| 起始各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述不正确的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器②中达平衡时放出的热量Q=23.15kJ
D.若容器①体积为0.5L,则平衡时放出的热量小于23.15kJ
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三10月月考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.可以用Si3N4、Al2O3制作高温结构陶瓷制品
B.雾霾天气首要污染物为PM2.5(指大气中直径小于或等于2.5微米的颗粒物),PM2.5在空气中一定形成气溶胶
C.化学家鲍林提出了氢键理论和蛋白质分子的螺旋结构模型,为DNA分子双螺旋结构模型的提出奠定了基础
D.据测定,许多反应的温度每升高10K,其反应速率增加2~4倍。在实验室或工业生产中,常采用加热的方法使化学反应在较高的温度下进行,以提高反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com