
【题目】下图中甲和乙均是盐桥原电池装置。请按要求填空
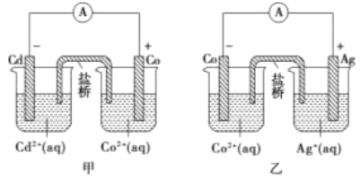
(1)甲中Co电极发生的反应方程式为_____________________________________。
(2)两烧杯中盐桥(填充物为浸有饱和KNO3溶液的琼脂)的作用是__________并使两烧杯中溶液保持电中性。
(3)判断反应2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq)能否自发进行并解释理由_________________________。
(4)开始时,乙电池左右烧杯各含100溶液,且Co2+、Ag+浓度均为4mol/L,当有1.204×1022个电子通过外电路时,两烧杯溶液中Co2+、Ag+浓度差为__________(忽略溶液的体积变化)。
【答案】 Co2++2e-=Co 将两个烧杯组成的内电路连接起来形成闭合回路 不能,因为由甲乙两图可知,还原性Cd>Ag,因此该反应不能自发进行 0.3mol/L
【解析】甲图中,Cd作负极,负极上失电子发生氧化反应,Co作正极,正极上溶液中金属阳离子得电子发生还原反应生成金属单质;乙图中,Co作负极,负极上失电子发生氧化反应,Ag作正极,正极上银离子得电子发生还原反应生成银单质,据此解答。
(1)根据装置图可判断甲中Co电极是正极,溶液中的Co2+发生得到电子的还原反应,即发生的反应方程式为Co2++2e-=Co。
(2)原电池放电时,负极上失去电子,正极上得电子,电子从负极沿导线流向正极,如果没有盐桥,不能形成闭合回路,没有电流产生,所以盐挢的作用是将两个烧杯组成的内电路连接起来形成闭合回路,并使两边溶液保持电中性。
(3)根据甲乙两图可知,还原性Cd>Ag,因此该反应2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq)不能自发进行。
(4)1.204×1022个电子的物质的量是1.204×1022/6.02×1023mol-1=0.02mol,则Co2+浓度增加0.1mol/L,Ag+浓度减少0.2mol/L,所以两烧杯溶液中Co2+、Ag+浓度差为0.3mol/L。


科目:高中化学 来源: 题型:
【题目】明代宋应星所著《天工开物》中已经记载了我国古代用炉甘石(主要成分ZnCO3)和煤冶锌工艺,锌的主要用途是制造锌合金和作为其他金属的保护层。回答下列问题:
(1)Zn原子基态核外电子排布式为_____________________________。
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①与SO42-互为等电子体的阴离子化学式为________________(写出一种)
②氨的热稳定性强于膦(PH3),原因是____________________________。
(3)黄铜是由铜和锌所组成的合金,元素铜与锌的第一电离能分别为ICu=746 kJ·mol-1,IZn=906 kJ·mol-1,ICu< IZn的原因是___________________。
(4)《本草纲目》中记载炉甘石(主要成分ZnCO3)可止血,消肿毒,生肌,明目……。Zn、C、O电负性由大至小的顺序是_________________。ZnCO3中阴离子的立体构型是_____________________。
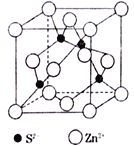
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶胞结构如图所示,每个Zn原子周围最近的Zn原子数目为________________。晶胞边长为apm,阿伏加德罗常数的值为NA,则ZnS晶体的密度为 __________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由化合物A 等为原料合成蒽环酮的中间体G 的合成路线如下:
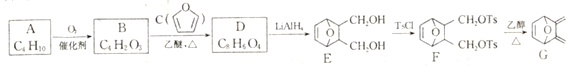
已知以下信息:
①B 中含有五元环状结构; ![]() ;
;
②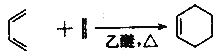 ;
;
③(CH3CO)2O或CH3COOC2H5![]() 2CH3CH2OH。
2CH3CH2OH。
回答下列问题:
(1)A的化学名称是____________________________。
(2)由B生成D和F生成G 的反应类型分别是_________________、____________________。
(3)D的结构简式为_____________________________。
(4)由E 生成F 的化学方程式为__________________________________。
(5)芳香化合物X是D 的同分异构体,X 分子中除苯环外不含其他环状结构,X 能与Na2CO3溶液反应,其核磁共振氢谱有4 组峰,峰面积之比为1:1:2 :2。写出1种符合要求的X 的结构简式:________________________________________________。
(6)写出以环戊烯(![]() ))和丙烯酸乙酯(
))和丙烯酸乙酯(![]() )为原料制备化合物
)为原料制备化合物![]() 的合成路线:_________________________________________________________(其他试剂任选)。
的合成路线:_________________________________________________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从KNO3和少量NaCl杂质的混合物中提纯KNO3 . 涉及的操作依次有:①溶解、②过滤、③结晶、④冷却、⑤蒸发浓缩.其中合理的是( )
A.①②③④⑤
B.①③⑤④②
C.①⑤④③②
D.①②⑤③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为0.4L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),升高温度,混合气体的颜色变深。回答下列问题:
2NO2(g),升高温度,混合气体的颜色变深。回答下列问题:
(1)该反应的△H_______0(填“>”或“<”下同)。
(2)100℃时,体系中各物质浓度随时间变化如图所示。
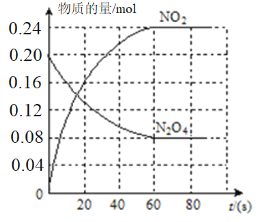
在0~60s时段,反应速率v(N2O4)为__________;反应的平衡常数K的值为_________。反应达平衡后,再向容器中充入0.4molN2O4。平衡向_________(填“正反应”或“逆反应”)方向移动,再次达到平衡时,N2O4的转化率与原平衡相比_________(填“变大”“变小”或“不变”)。
(3)100℃,相同容器中充入2.4molNO2与0.8molN2O4,则反应达平衡之前v正_____v逆。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是
A. 乙烯的比例模型:![]() B. S2-的结构示意图:
B. S2-的结构示意图:![]()
C. KCl的电子式:![]() D. 丙烯的结构简式:CH3CH=CH2
D. 丙烯的结构简式:CH3CH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体类型为 .
(2)①CH2=CH2、②CH≡CH、③ ![]() 、④CH3﹣CH3这四种分子中碳原子采取sp2杂化的是(填序号).
、④CH3﹣CH3这四种分子中碳原子采取sp2杂化的是(填序号).
(3)如图为某晶体的一个晶胞示意图,该晶体由A、B、C三种基本粒子组成,则该晶体的化学式为 . 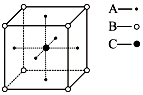
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价层电子对互斥理论预测H2S和CH2O的立体结构,两个结论都正确的是( )
A. 直线形;三角锥形 B. V形;三角锥形
C. 直线形;平面三角形 D. V形;平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度均为01mol·L-1、体积均为100mL的两种一元酸HX、HY溶液中,分别加入NaOH的稀溶液,lg![]() 随加入NaOH的物质的量的变化如图所示。下列说法正确的是( )
随加入NaOH的物质的量的变化如图所示。下列说法正确的是( )
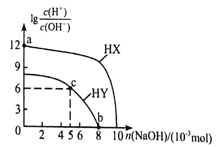
A. a点溶液的ph=2
B. 水的电离程度:a<b<c
C. b点溶液中:c(Yˉ)+c(HY)=c(Na+)
D. c点溶液中:c(Yˉ)>C(Na+)>c(HY)>c(H+)>c(OHˉ)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com