
| 物质 组别 | 甲 | 乙 | 丙 |
| A | SO2 | Ba(OH)2 | NaHCO3 |
| B | Na2O2 | H2O | CO2 |
| C | Na2SiO3 | NaOH | HCl |
| D | Al | H2SO4 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
分析 A.SO2与Ba(OH)2、NaHCO3反应,且Ba(OH)2与NaHCO3反应;
B.Na2O2与H2O、CO2反应,但H2O与CO2反应;
C.HCl与NaOH、Na2SiO3反应,且NaOH与Na2SiO3不反应;
D.Al与H2SO4、NaOH均反应,且H2SO4与NaOH反应;
解答 解:A.SO2与Ba(OH)2反应生成亚硫酸钡和水,SO2与NaHCO3反应生成亚硫酸钠和二氧化碳,且Ba(OH)2与NaHCO3反应生成碳酸钡,组内任意两种物质在一定条件下均能发生反应,故A不选;
B.Na2O2与H2O发生氧化还原反应生成氢氧化钠和氧气,Na2O2与CO2反应生成碳酸钠和氧气,且H2O与CO2反应生成碳酸,组内任意两种物质在一定条件下均能发生反应,故B不选;
C.HCl与NaOH反应生成氯化钠和水,HCl与Na2SiO3反应生成氯化钠和硅酸,但NaOH与Na2SiO3不反应,则不满足组内任意两种物质在一定条件下均能发生反应,故C选;
D.Al与H2SO4反应生成硫酸铝和氢气,Al与NaOH溶液反应生成偏铝酸钠和氢气,且H2SO4与NaOH反应生成Na2SO4和水,组内任意两种物质在一定条件下均能发生反应,故D不选;
故选C.
点评 本题考查考查物质之间的反应,把握常见物质的性质及发生的化学反应为解答的关键,注意某些反应与量有关,明确性质与反应的关系即可解答,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 230Th和232Th是钍的两种同素异形体 | |
| B. | H2与T2互为同位素 | |
| C. | 甲醇与乙醇互为同系物 | |
| D. | 乙酸乙酯与丁酸互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
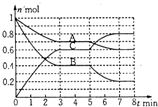 在一固定容积为2L的密闭容器中,气态物质A、B、C的物质量n(mol)随时间t(min)的变化如图所示.已知:平衡后,降低温度,A的转化率增大.下列选项中,能表明该反应一定达到平衡状态的是( )
在一固定容积为2L的密闭容器中,气态物质A、B、C的物质量n(mol)随时间t(min)的变化如图所示.已知:平衡后,降低温度,A的转化率增大.下列选项中,能表明该反应一定达到平衡状态的是( )| A. | V正(A)=2V逆(B) | B. | 容器内混合气体的密度保持不变 | ||
| C. | 容器内的总压强保持恒定 | D. | A、B的转化率之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
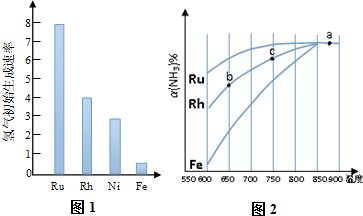
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
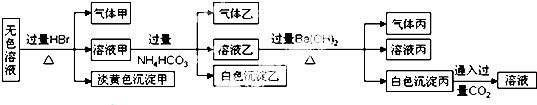
| A. | 淡黄色沉淀甲不可能为AgBr | |
| B. | 由溶液甲生成气体乙的途径只有:Al3++3HCO3-═Al(OH)3↓+3CO2↑ | |
| C. | 气体甲可能是混合气体 | |
| D. | 综合上述信息可以确定肯定存在的离子有:Na+、AlO2-、S2O32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
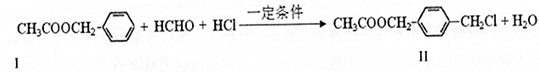
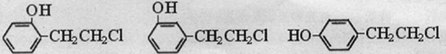 或
或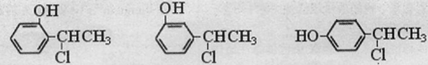 .
.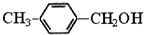 ,请写出其涉及的反应(著注明反应的条件)
,请写出其涉及的反应(著注明反应的条件) 、
、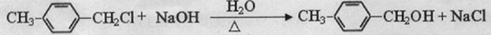 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
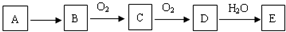
 ,A既能与强酸又能与强碱反应,且都能产生气体,则A的化学式为(NH4)2S或NH4HS.
,A既能与强酸又能与强碱反应,且都能产生气体,则A的化学式为(NH4)2S或NH4HS.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Fe3+)=c(Cl-) | B. | 3c(Fe3+)=c(Cl-) | C. | 3c(Fe3+)>c(Cl-) | D. | 3c(Fe3+)<c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
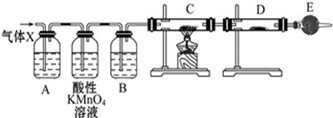
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com